



Nuevos casos de leucismo en peces andinos del género Astroblepus (Siluriformes: Astroblepidae) Leucismo en peces andinos
New records of leucism in Andean fish of the genus Astroblepus (Siluriformes: Astroblepidae)
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
Recepción: 18 Septiembre 2017
Aprobación: 25 Noviembre 2018
Resumen: La ictiofauna Sudamericana es la más diversa del mundo, sin embargo, es también la menos estudiada. Por ejemplo, son escasos los reportes de casos de aberraciones pigmentarias en peces dulceacuícolas, especialmente en especies altoandinas. Este estudio reporta dos nuevos casos de leucismo en dos especies del género Astroblepus (Siluriformes: Astroblepidae). Los individuos presentaron despigmentación en casi todo el cuerpo, excepto en el iris ocular, pedúnculo caudal, aletas dorsales y caudales. Posiblemente, la endogamia y la contaminación de sus hábitats estén causando estrés en estas poblaciones de peces, potenciado la aparición de esta aberración.
Palabras clave: Peces dulceacuícolas, Siluriformes, Aberraciones pigmentarias, Contaminación de hábitats.
Abstract: The South American ichthyofauna is the most diverse in the world, however, it is the least studied. For example, there are few reports of pigmentation anomaly in freshwater fishes, especially in high Andean species. This study reports two new cases of leucism in two species of the genus Astroblepus (Siluriformes: Astroblepidae). The individuals presented depigmentation in all body, except in the ocular iris, caudal peduncle, dorsal and caudal fins. Possibly, inbreeding and habitats contamination are causing stress in these fish populations, enhacing the appearance of this aberration.
Keywords: Freshwater fishes, Siluriformes, Pigmentation anomaly, Contamination of habitats.
La coloración tegumentaria en los peces es producida por los cromatóforos, que incluyen a los melanóforos, xantóforos, eritróforos, leucóforos e iridóforos [1]. La carencia de pigmento tegumentario causa coloraciones anormales en los peces, y de acuerdo con las características fenotípicas de los individuos, se denominan albinismo, leucismo, melanismo, xantismo, ambicoloración, metacromismo y policromismo [2-5]. El leucismo es atribuido a la mutación de genes recesivos en el desarrollo embrionario, lo cual, inhibe la migración de melanoblastos (células productoras de pigmentos) de la cresta neural a la capa basal de la epidermis [6,7]. Generalmente se manifiesta en los organismos por la ausencia total o parcial de la pigmentación en la piel, pero una pigmentación normal de las retinas [8-10]. Sin embargo, en muchos casos, la etiología de las aberraciones cromáticas no está clara y varios factores, incluyendo mutaciones genéticas no patológicas, aislamiento poblacional, estrés ambiental y la exposición a metales pesados pueden estar implicados en el surgimiento de estas anomalías [11 -13].
En peces dulceacuícolas sudamericanos se ha reportado casos de aberraciones pigmentarias en especies de las familias Erythrinidae, Lebiasinidae, Doradidae, Pimelodidae, Callichthyidae, Loricariidae, Atroblepidae, Gymnotidae y Lepidosirenidae [14-17]. Entre las especies de la familia Astroblepidae, un grupo de pequeños bagres neotrópicales, se han reportado ocurrencia de leucismo en Astroblepus ubidiai procedente de una población aisladas de la cuenca del río Mira y en Astroblepus pholeter que habitan la caverna de Latas, Cuenca del río Ñapo [15, 16]. El objetivo del presente estudio es reportar casos de leucismo en Astroblepus flssldens y Astroblepus brachycephalus. Los ejemplares leucísticos provienen de metapoblaciones, que habitan cuerpos de agua en la región Andina y Litoral de Ecuador (Fig. 1).
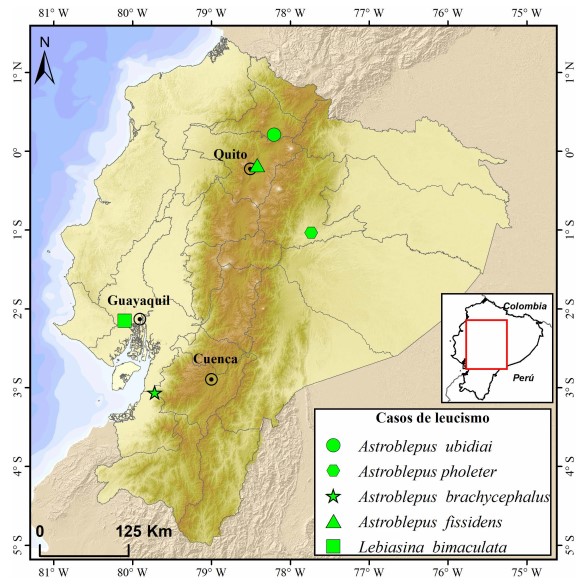
Distribución espacial de los casos de leucismo en peces dulceacuícolas en Ecuador
Un macho adulto de A. fissidens de 70,23mm de longitud estándar con leucismo fue fotografiado (cámara SONY DSC-W830) en la vertiente Amabulo, afluente del río San Pedro, parroguia Nayón, cantón Quito, provincia de Pichincha, cuenca alta del río Esmeraldas, (-0.1 75447S-78.418791 W, 2100m), el 28 de febrero 2012. Un macho juvenil de A. brachycephalus de 40,75 mm de longitud estándar con leucismo fue colectado en el río Villa, cantón Ponce Enríguez, provincia de Azuay, cuenca del río Siete (-3.063201 S -79.719691W, 359m), el 24 de abril 2012. No se colectó el ejemplar leucístico de A. fissidens y su evidencia se está registrada en archivos fotográficos. El espécimen de A. brachycephalus se encuentran depositados en el Museo Ecuatoriano de Ciencias Naturales, Instituto Nacional de Biodiversidad (MECN-DP3528).

Patrón de coloración típicos y leucísticos: A). Ejemplar de Astroblepus fissidens con coloración normal (98 mm); B). Ejemplar de Astroblepus fissidens leucistico (70,23mm); C) Ejemplar de Astroblepus brachycephalus con coloración normal (94,34mm); D). Ejemplar de Astroblepus brachycepha- lus leucistico (40,75mm). Fotografías: F. Anaguano-Yancha.
Los individuos de A. fissidens y A. brachycephalus generalmente presentan un variado patrón de coloración, típicamente presentan dorsos de color marrón, pardo obscuro o gris, con manchas pegcieñas de diversas tonalidades de negro, marrón y blanco. Las aletas pueden presentar los mismos colores y patrones mencionados para el dorso o pueden ser amarillas (Figs. 2A, C). Los ejemplares leucísticos presentaron despigmentación en todo el cuerpo, excepto en el pedúnculo, parte superior de la cabeza y en los radios duros de la aleta dorsal y caudal, donde observamos pegueñas manchas oscuras; en ambos casos la coloración de la piel es rosada-rojiza (Figs. 2B, D).
A pesar de la enorme diversidad de especies de peces presentes en Sudamérica, los reportes de aberraciones pigmentarias en la ictiofauna son muy escasos. Actualmente existen 20 casos reportados en 18 especies. Ocho casos se han reportado en Brasil, cuatro en Argentina, tres en Ecuador, un caso en Uruguay y tres casos no proporcionar referencias sobre la localidad, el 70% de estos casos corresponden albinismo y 30% a leucismo [Tabla 1], En Ecuador son recientes los reportes de leucismo en vertebrados, atribuidos principalmente a la alta probabilidad de endogamia a causa del aislamiento poblacional [15, 30], Además, recientemente se ha corroborado la reducción de pigmentación en astroblépidos gue habitan galerías subterráneas [16],
A nivel global, los ecosistemas de agua dulce son los más amenazados, principalmente, por el crecimiento de la población humana y el desarrollo económico [31, 32], Las condiciones físicas y guímicas del agua son frecuentemente modificadas por el incremento de sedimentos en el agua, la remoción del sustrato, la reducción del volumen de agua, la construcción de presas y las descargas de vertimientos residuales sin tratamiento previo, provenientes de la industria y de las cloacas de ciudades y poblados [33, 34], Estas afectaciones modifican la estructura y conexión de los sistemas acuáticos dentro de la red hídrica ocasionando el aislamiento poblacional, interrumpiendo el flujo génico [34], Sumado a esto, la contaminación por metales pesados causa efectos importantes en las condiciones de salud de los peces, así como también afecciones genéticas [12, 35],
Varios estudios han expuesto gue las altas frecuencias de aberraciones pigmentarias en poblaciones de fauna silvestre podrían ser indicativos de aislamiento poblacional, contaminación, exposición a metales pesados o estrés ambiental [11-13, 27], Durante varias décadas, los ríos San Pedroy Siete han sido contaminados por descargas industriales y domésticas de las ciudades y poblados aledaños. Análisis de sus aguas y sedimentos indican gue hay un grado de perturbación antropogénico muy severo [36,37], lo gue ha provocado gue las poblaciones de A. fissidens y A. brachycephalus gueden aisladas en pegueños esteros sin conexión hacia la cuenca principal, reduciéndose el flujo genético, cual lo reportado para ecosistemas acuáticos en los Andes Tropicales gue presentan un alto grado de contaminación [34], Probablemente el aislamiento poblacional, aumente la ocurrencia de endogamia propiciando la manifestación de aberraciones cromáticas. Sin embargo, no se puede aseverar gue esta sea la causa, razón por la cual, es necesario realizar estudios futuros sobre la variabilidad genética de estas especies en las cuencas antes mencionada para probar esta hipótesis.
Otra posible explicación de la manifestación de aberraciones cromáticas en A. brachycephalus podría estar relacionada con desordenes genéticos causados por la exposición a metales pesados, como los evidenciados en arroyos que sufren contaminación desús sustratos por Cadmio (Cd) y Cromo (Cr) en Brasil [12], La extracción de oro constituye una fuente importante de contaminación por metales pesados de los ríos que drenan las áreas mineras del cantón Camilo Ponce Enríquez, donde se ha reportado altas concentraciones de metales pesados en sus sedimentos, especialmente de Cd [37], que supera los estándares de calidad de los sedimentos establecidos por el Ministerio del Ambiente de Canadá para la protección de la fauna acuática [38], A pesar de esto, no se puede aseverar que esta sea la causa, ya que se ha reportado altos contenidos de metales pesados en peces bentónicos [37], así como también en aves [39], sin embargo, no encontraron casos de aberraciones pigmentarias, razón por la cual, es indispensable realizar una investigación más exhaustiva de estos aspectos en las concesiones mineras del Ecuador, para determinar si la exposición a metales pesados propicia la manifestación de aberraciones cromáticas en la fauna silvestre.

Hábitats de los registros de leucismo: A) Vertiente Amabulo; B) Río San Pedro, nótese el alto grado de contaminación; C) Río Villa; D) Actividad minera en el río Villa. Fotografías: J. Juina (A), F. Anaguano-Yancha (C, B),T. Meza (D).
| Orden | Familia | Especie | Aberración cromática | País | Referencia |
| Characiformes | Erythrinidae | Hoplias malabaricus | Albinismo | Brasil | [18] |
| Lebiasinidae | Lebiasina bimaculata | Leucismo | Ecuador | [17] | |
| Gymnotiforme | Gymnotidae | Gymnotuscarapo | Albinismo | Brasil | [19] |
| Gymnotuscarapo | Albinismo | Brasil | [20] | ||
| Siluriformes | Doradidae | Oxydoras knerii | Albinismo | Argentina | [21] |
| Heptapteridae | Impartíais mirini | Albinismo | Brasil | [22] | |
| Pimelodidae | Zungarozungaro | Albinismo | Argentina | [23] | |
| Rhandella minuta | Albinismo | Brasil | [24] | ||
| Pseudopimelodus sp. | Albinismo | — | [25] | ||
| Phractocephalushemioliopterus | Albinismo | — | [25] | ||
| Callichthyidae | Corydoras paleatus | Albinismo | Brasil | [26] | |
| Megalechis thoracata | Albinismo | Argentina | [21] | ||
| Corydoras aeneus | Albinismo | Brasil | [25] | ||
| Loriicaridae | Rhinelepis áspero | Albinismo | Uruguay | [27] | |
| Rhinelepis aspera | Leucismo | Brasil | [14] | ||
| Hypostomusplecostomus | Albinismo | — | [25] O | ||
| Schizolecis guntheri | Albinismo | Brasil | [28] | ||
| Astroblepidae | Astroblepus ubidiai | Leucismo | Ecuador | [15] | |
| Astroblepus pholeter | Leucismo | Ecuador | [16] £ | ||
| Astroblepus brachycephalus | Leucismo | Ecuador | Este estudio qc | ||
| O | |||||
| Astroblepus fissidens | Leucismo | Ecuador | Este estudio | ||
| Ceratodontiformes | Lepidosirenidae | Lepidosiren paradoxa | Albinismo | Argentina | [29] |
Aberraciones cromáticas reportadas para Sudamérica en peces de agua dulce.
Agradecimientos
Agradezco a la Consultora socio ambiental AmbienConsul, que contrató mis servicios para la realización de evaluaciones faunísticas en varios puntos del proyecto minero Gaby-Papagrande (provincia de Azuay), en el marco del desarrollo de los estudios socioambientales que se realizaron en la zona. A. Naveda, J. Brito, D. Racines y dos revisores anónimos revisaron el manuscrito, realizando valiosos aportes. La Dirección Provincial del Ambiente del Azuay otorgó la autorización de investigación Nº 019-AZ-2011.
Referencias
Fujii, R. (2000). The regulation of motile activity in fish chromatophores. Pigment Cell Research, 13(5), 300-319. doi: http://www.dx.doi.Org/10.1034/j.1600-0749.2000.130502.x
Dawson, C. (1964). A Bibliography of Anomalies of Fishes. Gulf Research Reports, 1 (6), 308-399. doi: http://www.dx.doi.org/10.18785/grr.0106.01
Dawson, C. (1966). A Bibliography of Anomalies of Fishes, Supplement 1. Gulf Research Reports, 2 (2), 169-176. doi: http://www.dx.doi.org/10.18785/grr.0202.03
Dawson, C. (1971). A Bibliography of Anomalies of Fishes, Supplement 2. Gulf Research Reports, 3 (2): 215-239. doi: http://www.dx.doi.org/10.18785/grr.0302.05
Dawson, C. & Heal, E. (1976). A Bibliography of Anomalies of Fishes: Supplement 3. Gulf Research Reports, 5 (2), 35-41. doi: http://www.dx.doi.org/10.18785/grr.0502.05
Shin, M. K. (2000). Controlling Gene Expression in Mice with Tetracycline: Application in Pigment Cell Research. Pigment Cell Research, 13, 326-331. Recuperado de: https://onlinelibrary.wiley.com/doi/pdf/10.1034/j.1600-0749.2000.130504.x
Sugimoto, M. (2002). Morphological Color Changes in Fish: Regulation of Pigment Cell Density and Morphology. Microscopy Research and Technigue, 58,496-503. doi: https://doi/pdf/10.1002/jemt.10168
Clark, S. (2002). First Report of Albinism in the White- Spotted Bamboo Shark, Chiloscyllium plagiosum (Orectolobiformes: Hemiscyllidae), With a Review of Reported Color Aberrations in Elasmobranchs. Zoo Biology, 21, 519-524. doi: https://doi.org/10.1002/zoo.10068
Evangelista-Leal, M., Horst-Schulz, U., Lehmann-Albornoz, R, Machado, R., & Ott, P. H. (2013). First record of partial albinism in two catfish species ofGenidens (Siluriformes: Ariidae) in an estuary of Southern Brazil. Brazilian Archives of Biology and Technology, 56(2), 237-240. Recuperado de: http://www.scielo.br/pdf/babt/v56n2/08.pdf
Bigman, J. S., Knuckey, J. D. S. & Ebert, D. (2015). Color aberrations in Chondrichthyan fishes: first records in the genus Bathyraja (Chondrichthyes: Rajiformes: Arhynchobatidae). Marine Biodiversity, 46(3), 579-587. doi: http://www.dx.doi.org/10.1007/s12526-015-0403-z
Bensch, S., Hansson, B., Hasselguist, D., & Nielsen, B. (2000). Partial albinism in a semi-isolated population of great reed warblers. Hereditas, 133, 167-170. doi: https://doi.Org/10.1111/j.1601-5223.2000.t01-1-00167.x
Baggio, H., & Horn, A. H. (2010). Teorestotais e distribuic,äo dos metais pesadosCu, Cd, Cr, Ni Pb e Zn nos sedimentos de corrente e fundo do rio do Formoso- MG. Geografias, 6,107-117. Recuperado de: http://www.igc.ufmg.br/portaldeperiodicos/index.php/geografias/article/view/504/375
Quigley, D. T. G., Lord, R., MacGabhann, D., & Flannery, K. (2017). First records of xanthochromism in three-bearded rockling Gaidropsarus vulgaris (Cloguet, 1824) and pollack Pollachius pollachius (Linnaeus, 1758). Journal Applied of Ichthyology, 33(6), 1208-1210. doi: https://doi.Org/10.1111/jai.13456
Nobile, A. B., Freitas-Souza, D., de Lima, F. P., Acosta, A., & Da Silva, R. J. (2016). Partial albinism in Rhinelepis aspera from the Upper Parana Basin, Brazil, with a review of albinism in South American freshwater fishes. Revista Mexicana de Biodiversidad, 87 (2), 531-534. doi: http://www.dx.doi.Org/10.1016/j.rmb.2016.04.005
Mena-Valenzuela, P., & Valdiviezo-Rivera, J. (2016). Leucismo en Astroblepus ubidiai (Pellegrin 1931) (Siluriformes: Astroblepidae), de la provincia de Imbabura, Ecuador. Biota Colombiana, 17 (1), 131-136. doi: http://www.dx.doi.org/10.21068/C2016v17r01a10
Espinasa, L., Robinson,J., Soares, D., Hoese, G.,Toulkeridis,T.&Toomey,T. (2018).Troglomorphicfeaturesof Astroblepus pholeter, a cavefish from Ecuador, and possible introgressive hybridization. Subterranean Biology,27, 17-29.
Nugra, F., Anaguano-Yancha, F., Arizaga, C, Zarate, E. & Brito, J (En prensa). Leucismo en el pez Lebiasina bimaculata (Characiformes: Lebiasinidae) en Guayas, Ecuador. Biota Colombiana, 19(2)
Silva,T., Aratijo,T. & Bicudo, A. (2013). First report of albinism intrahira Hoplias malabaricusfrom Brazil. Boletim do Institute de Pesca deSdo Paulo, 39,457-460. https://www.pesca.agricultura.sp.gov.br/39_4_457-460.pdf
Campos-da Paz, R. & Caramaschi, E. P. (1994). First record of albinism in a gymnotiform fish (Teleostei: Ostariophysi). Ichthyological Exploration of Freshwaters, 5,1-4.
Oliveira, C. & Foresti, F. (1996). Albinism in the banded knifefish, Gymnotus carapo. Tropical Fish Hobbyist, 44,92-96.
Panattieri, A. E. & Del Barco, D. M. (1980). Un caso de albinismo en armado chancho Oxidoras kneri Bleeker 1862, Pisces, Doradidae. Comunicaciones del Museo Provincial de Glendas Naturales Florentino Ameghino, 9,9-10.
Manoel, R, Ono, E. & Alves, I. (2017). First report of albinism in the South American catfish Imparfínís mirini (Siluriformes: Heptapteridae). Revista Mexicana de Bíodíversídad, 88(2), 471-473. https://www.sciencedirect.com/science/artide/pii/S1870345317300799
Taberner, R., Fernández-Santos, J. & Castelli, J. (1976). Un manguruyú albino Paulicea luetkeni (Steindachner 1876) Eigenmann 1910. Physis B, 35, 121-123.
Sazima, I. y Rombal, J. P. (1986). Um albino de Rhamdella minuta, com notas sobre comportamento (Osteichthyes, Pimelodidae). Revista Brasileira de Biología, 46,377-381. https://www.researchgate.net/publication/277776337_Um_albino_de_Rhamdella_minuta_com_notas_sobre_comportamento_Osteichthyes_Pimelodidae
Burgess, W. E. (1989). An atlas of freshwater and marine catfishes: a preliminary survey of the Siluriformes. New Jersey: TFH Publications. 784 pp.
Fach, D. (1963). Albinotische Corydoraspaleatus. Aguarien Terrarien Zeitschriften, 16,225-227.
Luengo, J. A. (1965). Un caso de albinismo en Rhinelepis aspera Agassiz del Uruguay (Pisces, Loricariidae). Neotropica, 11,51-52.
Brito, M. F. G. & Caramaschi, E. P. (2005). An albino armored catfish Schizolecisguntheri (Siluriformes: Loricariidae) from an Atlantic Forest coastal basin. Neotropical Ichthyology, 3, 123-125. http://www.scielo.br/pdf/ni/v3n1/v3n1a09.pdf
Azpelicueta, M. M. & Braga, L. (1984). Albinismo en Lepidosiren paradoxa Fitzinger, 1837 (Osteichthyes, Dipnoi, Lepidosirenidae). Neotropica, 30,75-78.
Brito, J., & Va Id i vieso-Bermeo, K. (2016). First records of leucism in eight species of small mammals (Mammalia: Rodentia). Therya, 7,483-489. doi: http://www.dx.doi.org/10.12933/therya-16408
Russi, D., Brink, R, Farmer, A., Badura, T., Coates, D., Förster, J., Kumar, R., & Davidson, N. (2013). The Economics of Ecosystems and Biodiversity for Water and Wetlands. London and Brussels: Institute for European Environmental Policy; Gland: Ramsar Secretariat. Recuperado de: https://www.ramsar.org/sites/default/files/documents/library/teeb_waterwetlands_report_2013.pdf
Vörösmarty, C.J., McIntyre, P.B., Gessner, M.O., Dudgeon, D., Prusevich, A., Green, R, Glidden, S., Bunn, S.E., Sullivan, C.A., Liermann, C.R., & Davies, P.M. (2010). Global threats to human water security and river biodiversity. Nature, 467, 555-561. doi: http://www.dx.doi.org/10.1038/nature0944010.1038/nature09440
Dudgeon, D. (2012). Threats to freshwater biodiversity globally and in the Indo-Burma Biodiversity Hotspot. En D. J. Allen, K. G. Smith, & W. R.T. Darwall (Eds.), The Status and Distribution of Freshwater Biodiversity in Indo-Burma, pp. 1-25. Cambridge and Gland, Switzerland: IUCN. Recuperado de: https://www.iucn.org/sites/dev/files/import/downloads/indo_burma_report_complete_low_res_28_aug_1.pdf
Tog nel li, M.F., Lasso, C.A., Bota-Sierra, C.A., Jimenez-Segura, L.F. & Cox, N.A. (Eds.). (2016). Estado de Conservación y Distribución de la Biodiversidad de Agua Dulce en los Andes Tropicales. Gland, Cambridge and Arlington: UICN. doi: http://dx.doi.org/10.2305/IUCN.CH.2016.02.es
Palacio, J.A. (2007). Ecotoxicología acuática. Medellín: Editorial Universidad de Antioguia.
Campaña, A., Guaiolo, E., & Chiluisa-Utreras, V. (2017). Evaluación físico-química y microbiològica de la calidad del agua de los ríos Machángara y Monjas de la red hídrica del distrito metropolitano de Quito. Bionatura, 2(2), 305-310. doi: http://www.dx.doi.Org/10.21931/RB/2017.02.02.6
Tarras-Wahlberg, N. H., Flachier, A., Fredriksson, G., Lane, S., Lundberg, B., & Sangfors, 0. (2000). Environmental Impact of Small-scale and Artisanal Gold Mining in Southern Ecuador: Implications for the Setting of Environmental Standards and for the Management of Small-scale Mining Operations. Ambio, 29(8), 484-491. doi: http://dx.doi.org/10.1579/0044-7447-29.8.484
Canadian Council of Ministers of the Environment. (2001). Canadian sediment guality guidelines for the protection of aguatic life: Summary tables. Updated. En Canadian Environmental Quality Guidelines, 1999. Winnipeg: Canadian Council of Ministers of the Environment. Recuperado de: https://www.elaw.org/system/files/sediment_summary_table.pdf
Albuja, L, Montalvo, L, Cáceres, F., & Jácome, N. (2011). Niveles de mercurio en aves silvestres de tres regiones mineras del sur del Ecuador. Revista Politécnica, 30(3), 18-32. Recuperado de: http://bibdigital.epn.edu.ee/bitstream/15000/5239/1/Mercurio-Aves-Ecuador%202012Politecnica30(3).pdf