Respuesta de la absorción de nitrógeno y fósforo de una variedad de maíz al inocular Azospirillum sp. y Pseudomonas fluorescens
Response of a maize variety in the absorption of nitrogen and phosphorus when inoculating Azospirillum sp. and Pseudomonas fluorescens
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
Recepción: 09 Noviembre 2017
Aprobación: 02 Mayo 2018
Resumen: El cultivo de maíz de altura constituye la base de la alimentación de la población rural de la sierra ecuatoriana, sin embargo el poco uso de tecnología ha hecho que los rendimientos de maíz de altura sean bajos. Por otro lado, el uso excesivo de fertilizantes sintéticos en ciertas partes del mundo está causando un grave impacto ambiental por lo que es necesario reducir su utilización y proporcionar alternativas válidas en la nutrición de las plantas. Por tal razón esta investigación tuvo como objetivo evaluar la eficiencia de un biofertilizante a base de una cepa fijadora de nitrógeno (Azospirillum sp) y una solubilizadora de fósforo (Pseudomonas fluorescens). Se utilizó un diseño de bloques completamente al azar con cinco tratamientos y seis repeticiones. Los tratamientos correspondieron a: T1 (Azospirillum sp.), T2 (Pseudomonas fluorescens), T3 (Azospirillum sp. + Pseudomonas fluorescens), T4 (Fertilización química con N y P) y T5 (control absoluto, sin inoculación ni fertilizante). Los resultados obtenidos revelaron que el mayor índice de efectividad de inoculación (IEI), en materia seca de la parte aérea, la obtuvo el T1 con un IEI de 50%; mientras que para la materia seca de la raíz el mejor resultado lo obtuvo el T3 con un IEI de 40%. En relación al contenido de (N) y (P) presentes en el tejido foliar, el T1 presentó la mayor absorción de (N) con 24.49 g.planta-1, mientras que el T3 presentó la mayor absorción de (P) con (10.86 g.planta-1). Estos resultados indican que los microorganismos contenidos en estos biofertilizantes contribuyeron a proporcionar los nutrientes requeridos por la planta para su desarrollo.
Palabras clave: Biofertilizante, Fertilización, Microorganismos.
Abstract: Maize is the basis of the food supply of rural population in the Ecuadorian highlands. The little use of technology in this crop causes low yield. Synthetic fertilizers and their indiscriminate use are causing a serious environmental impact in some regions of the world, reason why it is necessary to moderate its use and provide valid alternatives of nutrition for the crop. This research aimed to evaluate the efficiency of a biofertilizer based on a nitrogen fixing strain (Azospirillum) and a phosphorus solubilizer bacteria (Pseudomonas). A completely randomized block design with five treatments and six replicates was used: T1 (Azospirillum sp.), T2 (Pseudomonas fluorescens), T3 (Azospirillum sp. + Pseudomonas fluorescens), T4 (conventional chemical fertilization) and T5 (absolute control). The highest inoculation effectiveness index (IEI) for the dry matter of the aerial part of the plant was obtained with T1 (IEI = 50%), while the best result for the dry matter of the root was obtained with T3 (IEI = 40%). In relation to the content of (N) and (P) in the leaf tissue, T1 had the highest (N) absorption with 24.49 g.planta-1, while T3 had the highest (P) absorption with 10.86 P2O5 g.planta-1. These results indicate that the microorganisms contained in these biofertilizers contributed to provide the nutrients required by the plant for its development.
Keywords: Biofertilizer, Fertilization, Microorganisms.
INTRODUCCIÓN
El maíz suave (Zea mays L. var. amylacea) es uno de los cultivos más importantes en la sierra ecuatoriana debido a la gran cantidad de terreno destinado a su producción y al papel que cumple como componente básico de la dieta de la población rural [1]. Para el 2015 la superficie cosechada de maíz suave (solo y asociado) en choclo fue de 42448 ha y de maíz suave seco fue de 45874 ha [2].
El incremento en el rendimiento de esta especie está estrechamente relacionado con la fertilización. Después del nitrógeno, el fósforo constituye uno de los elementos más importantes en las primeras etapas del desarrollo normal de las plantas, una deficiencia de estos elementos en el cultivo puede provocar un crecimiento lento, poco desarrollo del sistema radicular y por ende una disminución el rendimiento de la cosecha [3].
En el Ecuador, el uso de fertilizantes en la agricultura constituye un grave problema de contaminación ambiental y perjuicio a la salud de la población expuesta a este tipo de componentes químicos [4]. Con la meta de mejorar la producción y el rendimiento agronómico de los cultivos se emplean fertilizantes químicos, los cuales al ser deficientemente asimilados por los cultivos terminan contaminando los suelos y la biodiversidad microbiana deteriorando así la calidad del suelo [5].
En los últimos años se han desarrollado alternativas para disminuir el uso de los fertilizantes sintéticos a través del uso de microorganismos benéficos que han demostrado cumplir funciones que mantienen el equilibrio del suelo y apoyan el crecimiento vegetal mediante diversos mecanismos, entre ellos está la solubilización de fosfatos y fijación de nitrógeno [6]. Actualmente, es de vital importancia investigar la microbiota del suelo con la finalidad de obtener estrategias que mejoren la productividad agrícola y disminuyan el uso de agroquímicos. Una de estas estrategias, es la aplicación de biofertilizantes provenientes de microorganismos benéficos los cuales asociados a las plantas pueden mejorar su crecimiento, desarrollo y rendimiento. Entre los géneros de rizobacterias más utilizados en la producción de biofertilizantes para gramíneas se encuentran; Azospirillum, Pseudomonas y Azotobacter [7].
El género Azospirillum y Pseudomonas, pertenecen a la subclase alfa de las proteobacterias, gram negativas. [8-9]. Estos microorganismos del suelo producen importantes efectos en la planta como, una implantación más rápida, mayor crecimiento de raíces, mayor tolerancia a patógenos, fijación biológica no simbiótica de nitrógeno y solubilización de nutrientes como el fósforo [10]. Una de las bondades agronómicas más considerables que se atribuyen a Azospirillum es su capacidad de promover el crecimiento vegetal y fijación de nitrógeno en los primeros estadios del ciclo del cultivo, especialmente bajo estrés moderado [11]. En tanto que los efectos atribuidos a Pseudomonas pueden resumirse en una acción de biocontrol, secreción de sustancias inductoras y solubilización de nutrientes como el fósforo [12].
Los biofertilizantes son productos a base de microorganismos que viven normalmente en el suelo, en poblaciones bajas, y que al incrementar sus poblaciones por medio de la inoculación artificial, son capaces de poner a disposición de las plantas una parte importante de los nutrientes que necesitan para su desarrollo, así como de suministrar sustancias hormonales o promotoras del crecimiento tales como auxinas, giberelinas, citocininas, etileno y ácido abscísico [13]. El uso de biofertilizantes elaborados a base de microorganismos benéficos Rhizobium, Azotobacter, micorrizas, Azospirillum, Pseudomonas, que viven asociados o en simbiosis con las raíces de las plantas, contribuyen eficientemente al proceso de nutrición de los cultivos y el mejoramiento de la fertilidad natural de los suelo proporcionando un efecto agrobiológico positivo en los cultivos agrícolas [14].
En relación a los biofertilizantes se ha generado un movimiento comercial, cuya producción y comercialización está encaminada al fortalecimiento de un sistema de producción sostenible y equilibrio ecológico del suelo al disminuir total o parcialmente el uso de fertilizantes sintéticos [15]. En este sentido, podría decirse que la microflora rizosférica es un potencial aliado de la agricultura para el uso de los recursos de manera sostenible [16]. El presente trabajo tuvo como objetivo evaluar la aplicación de un biofertilizante a base de una cepa de (Azospirillum sp.) fijadora de nitrógeno y una cepa solubilizadora de fósforo (Pseudomonas fluorescens) en el cultivo de maíz de altura.
MATERIALES Y MÉTODOS
La presente investigación se desarrolló en dos etapas en el período comprendido entre agosto del 2016 y marzo 2017 en la Estación Experimental Santa Catalina del Instituto Nacional de Investigaciones Agropecuarias (INIAP), localizada enla provincia de Pichincha, Cantón Mejía, Parroquia Cutuglagua. La primera etapa se llevó a cabo en condiciones de laboratorio con el objetivo de reactivar y purificar las cepas nativas liofilizadas de Azospirillum sp (C2) y Pseudomona fluorescens (nI5). Varios aislados de ambos géneros bacterianos se obtuvieron años atrás a partir de aislamientos colectados en la rizósfera del cultivo de maíz en su fenología V7 en las principales provincias maiceras de la sierra del Ecuador: Imbabura, Pichincha, Bolívar y Chimborazo. Con la ayuda de un barreno se tomó aproximadamente 3 kg de suelo a una profundidad de 15 cm. Las muestras de suelo fueron ingresadas al laboratorio del Programa de Maíz perteneciente al Instituto Nacional de Investigaciones Agropecuarias (INIAP), en donde se realizaron los trabajos de aislamiento, purificación, identificación, liofilización y trabajos de inoculación en condiciones controladas de invernadero y campo donde se seleccionaron los aislados C2 (A. sp) y nI5 (P. fluorescens). El lugar de procedencia de estos aislados se encuentran descritos en la Tabla 1.
| Provincia | Cantón | Parroquia | Barrio | Altitud m.s.n.m. | |
| C2 | Bolívar | Guaranda | Veintimilla | Laguacoto 2 | 2617 |
| nI5 | Imbabura | Cotacachi | El Sagrario | Tunibamba | 2422 |
Códigos y procedencia de los aislados empleados en la investigación.
Para la reactivación de las cepas liofilizadas se colocó 1000 ^L de peptona al 1%, en los tubos Eppendorf, mediante agitación hasta homogenizar la mezcla con la ayuda del vortex. Seguidamente, se tomaron 50 ^L del inóculo y se colocaron en placas Petri con el medio de cultivo sólido ácido málico- Agar-Rojo Congo para el caso de Azospirillum sp y King B para Pseudomonas fluorescens y con la ayuda de un triángulo de vidrio estéril se dispersó bien hasta la sequedad. Posteriormente se lo colocó en la incubadora a una temperatura de 30 °C por 7 días, pasado este tiempo se tomaron secciones puras de la bacteria con la ayuda de un haza de platino y se colocaron en placas Petri con los medios de cultivos específicos para estos géneros. La preparación del biofertilizante se realizó sobre un soporte líquido a base de melaza al 2% a una concentración bacteriana de 1x109 UFC.g-1.
La segunda fase de la investigación se realizó en condiciones de campo en un suelo Andisol, sin registros de cultivos previos. El experimento fue desarrollado en campo de agricultores de la lotización la UNIÓN, ubicada en Ecuador, Cantón; Quito, Provincia de Pichincha, Parroquia; Amaguaña, con una superficie neta de 900 metros cuadrados. Se ubica a -0.386075° (S) y -78.500944° (W), con una altitud de 2675 msnm Fig 1.
La preparación del suelo se realizó a mediados del mes de septiembre del 2017 y la siembra se realizó el 23 de noviembre, utilizándose la variedad de maíz suave INIAP-101, cuyas principales características son la precocidad, de color de grano blanco y textura harinosa. Su progenitor es la variedad “Cacahuazintle” introducida por el INIAP desde México. Los biofertilizantes a base de las cepas de Azospirillum sp. y Pseudomonas fluorescens, indicados anteriormente, fueron aplicados directamente a la semilla de maíz sin desinfectar.
Figura 1
Mapa de la ubicación del ensayo de investigación en campo.
Implantación de las parcelas dentro del lote fue de 5 m x 3.20 m, con cuatro surcos, que incluyeron 80 plantas por parcela, equivalente a una densidad de 50000 plantas. ha-1. La siembra se realizó a una distancia entre surcos de 0.80 m y entre planta de 0.25 m. Los tratamientos fueron cinco de acuerdo al manejo: T1 (Azospirillum sp.), T2 (Pseudomonas fluorescens), T3 (A. sp. + P. fluorescens), T4 (fertilización química con N y P) y T5 (control absoluto sin inoculación ni fertilización química), con seis réplicas, los cuales se ubicaron con un diseño experimental de bloques completamente al azar.
Las labores culturales de deshierba y aporque se realizaron de forma manual para mantener el ensayo libre de malezas. Se realizó una sola aplicación de insecticida a los cinco meses para el control del gusano del choclo (Heleiothis zea). La cosecha se realizó a los siete meses en maíz tierno, en estado de choclo.
Adicionalmente al peso de materia seca de raíces (MSR) y de parte aérea de la planta (MSPA), se evaluaron los siguientes parámetros:
Índice de efectividad de la inoculación de la materia seca (%)
En el momento de la cosecha en estado tierno (choclo), se procedió a la evaluación de la masa seca de la parte aérea en kg por planta y se calculó el índice de efectividad de la inoculación (IEI) expresado en porcentaje utilizando la siguiente formula:

Análisis químico de nitrógeno y fósforo presentes en el suelo
A la cosecha del maíz en estado tierno (choclo), por cada parcela neta se realizó un análisis químico de nitrógeno y fósforo presentes en el suelo. Estas muestras fueron ingresadas al laboratorio de Suelos del INIAP, en donde fueron analizadas mediante los métodos semimicro Kjendah para nitrógeno total y mediante Olsen para fósforo [17].
Análisis químico de nitrógeno y fósforo presentes en el tejido foliar
Se tomaron cinco plantas por tratamiento en estado lechoso (R3) para realizar el análisis de nitrógeno y fósforo presentes en la planta. Las muestras fueron secadas e ingresadas al laboratorio del Departamento Nacional de Suelos y Aguas del INIAP, donde fueron analizadas mediante los métodos (semimicro Kjendah) para nitrógeno total y mediante el reactivo de Bartons (metavanadato y molibdato) para la determinación del fósforo [17].
RESULTADOS
Existieron diferencias estadísticamente significativas entre los tratamientos para la variable de materia seca de la raíz (MSR). El mejor tratamiento fue con la combinación de Azospirillum y Pseudomonas (T3) que obtuvo el mayor peso con un valor de 0.14 kg.planta-1, diferenciándose estadísticamente del control absoluto sin inoculación Tabla 2. Se debe destacar que los tratamientos con la inoculación individual de biofertilizantes y el control de químico (con fertilización N y P) no mostraron diferencias significativas entre sí. Un comportamiento muy similar se observó en la producción de materia seca de la parte aérea (MSPA) existiendo diferencias significativas entre ambos controles.
| Tratamientos | MSPA (kg.planta-1) | IEI (%) | MSR (kg.planta-1) | IEI (%) | |
| T1 | Azospirillum sp. | 0.18 a | 50 | 0.11 ab | 10 |
| T2 | Pseudomonas fluorescens | 0.17 a | 42 | 0.13 ab | 30 |
| T3 | Azospirillum sp. + Pseudomonas fluorescens | 0.17 a | 42 | 0.14 a | 40 |
| T4 | Control químico con ( N y P) | 0.16 ab | 33 | 0.10 ab | 0 |
| T5 | Control absoluto sin inoculación | 0.12 c | 0 | 0.10 b | 0 |
En la Fig. 2 se observa que el nitrógeno (N) disminuyó en todos los tratamientos en comparación al análisis de suelo inicial que fue de (57.00 ppm). En cuanto al fósforo (P) presente en el suelo se observó un aumento de 0.68 ppm para el tratamiento T3 y 1.13 ppm para el tratamiento T4; no así en los tratamientos T1, T2 y T5 en donde los niveles de fósforo disminuyeron en relación al análisis de suelo inicial, el cual fue de 11.00 ppm. Por otro lado el testigo con fertilización química tuvo el mayor contenido de fósforo en la solución del suelo.
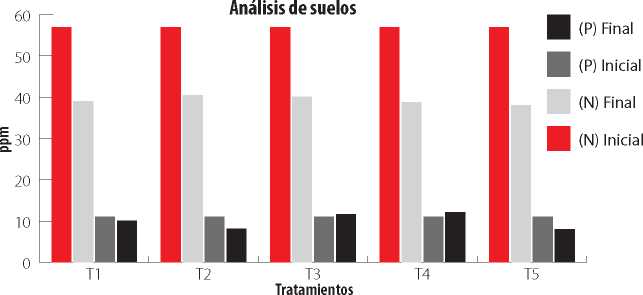
Figura 2
Análisis químico de N y P presente en el suelo antes de la siembra y a la cosecha de una variedad de maíz inoculado con biofertilizantes.
Tratamientos: T1, Azospirillum sp.; T2, Pseudomonas fluorescens; T3, Azospirillum sp. + Pseudomonas fluorescens; T4, Control Químico con (N y P); T5, Control absoluto (sin inoculación).
En la Tabla 3 se muestran los porcentajes de (N, P, K, Ca, Mg) presentes en el tejido foliar del cultivo de maíz en su estadio fenológico (R3). El tratamiento T3 (Azospirillum sp. + Pseudomonas fluorescens) presentó un mayor porcentaje de acumulación de (N, P, K) en el tejido foliar, en comparación con los tratamientos T4 (control químico) y T5 (control absoluto).
| Tratamientos* | N (%) | P (%) | K (%) | Ca (%) | Mg (%) |
| T1 | 5.57 | 1.39 | 6.35 | 0.89 | 0.82 |
| T2 | 5.72 | 1.31 | 6.52 | 0.83 | 0.82 |
| T3 | 5.94 | 1.61 | 7.05 | 0.72 | 0.77 |
| T4 | 5.61 | 1.45 | 6.00 | 0.73 | 1.18 |
| T5 | 5.43 | 1.14 | 5.93 | 0.64 | 0.74 |
| *Tratamientos: T1, Azospirillum | sp.; T2, Pseudomonas | fluorescens; T3, Azos | pirillum sp. + Pseudo | onas fluorescens; T4, | Control químico con |
*Tratamientos: T1, Azospirillum sp.; T2, Pseudomonas fluorescens; T3, Azospirillum sp. + Pseudomonas fluorescens; T4, Control químico con (N y P); T5, Control absoluto (sin inoculación).
Como se observa en la Fig. 3, los mayores contenidos de nitrógeno foliar absorbido por la planta en el momento de la cosecha en estado choclo correspondieron a los tratamientos con la inoculación individual y combinada de A. sp. y P. fluorescens (tratamientos T1, T2 y T3), los cuales no difieren significativamente entre sí (p>0.05), pero con diferencias significativas con respecto a los tratamientos controles con fertilización química (con N y P) y control absoluto.
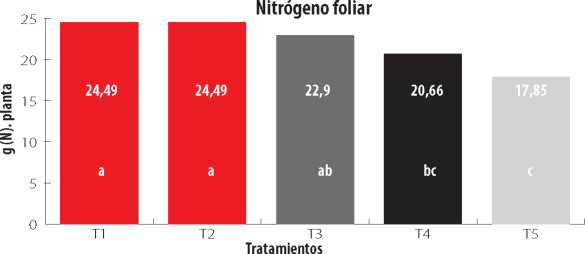
Figura 3
Contenido de Nitrógeno en el tejido foliar de plantas de maíz inoculadas con diferentes biofertilizantes.
Tratamientos: T1, Azospirillum sp.; T2, Pseudomonas fluorescens; T3, Azospirillum sp. + Pseudomonas fluorescens; T4, Control Químico con (N y P); T5, Control absoluto (sin inoculación). Medias con letras iguales no difieren significativamente según la prueba de Tukey (p<0,05).
En cuanto al contenido de P, no se observaron diferencias estadísticas significativas entre los tratamientos T1, T2, T3 y T4. Se observaron diferencias significativas entre el tratamiento T1 (Azospirillum sp.) y control absoluto T5 Fig. 4.
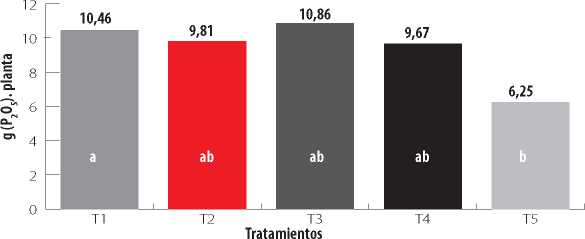
Figura 4
Contenido de fósforo en el tejido foliar de plantas de maíz con diferentes biofertilizantes.
Tratamientos: T1, Azospirillum sp.; T2, Pseudomonas fluorescens; T3, Azospirillum sp. + Pseudomonas fluorescens; T4, Control químico con (N y P); T5, Control absoluto (sin inoculación). Medias con letras iguales no difieren significativamente según la prueba de Tukey (p<0,05).
DISCUSIÓN
La materia seca de la parte aérea (MSPA) y la raíz (MSR) e índice de efectividad de la inoculación (IEI) de maíz muestran que los biofertilizantes inoculados afectaron positivamente la producción de materia seca de la parte aérea y la raíz, obteniéndose valores de índice de eficiencia a la inoculación (IEI) superiores a ambos controles.
Las hormonas de crecimiento contenidas en los biofertilizantes, a base de Pseudomonas fluorescens, incrementaron la longitud radicular (resultados no mostrados), mientras que la aplicación de hormonas de crecimiento contenidos en biofertilizantes a base de Azospirillum sp., incrementaron la biomasa vegetal al alcanzar los mayores valores en la fijación de nitrógeno, con un efecto positivo en el desarrollo vegetativo del maíz, incrementando la masa seca de la parte aérea y raíces de las plantas. El incremento de la biomasa vegetal estaría relacionado con el efecto de las fitohormonas tales como: auxinas, giberelinas, citocininas, etileno y ácido abscísico, liberados en los exudados metabólicos por parte de las bacterias promotoras del crecimiento [18-19].
La absorción de fósforo en las primeras etapas del desarrollo de la planta de maíz influye en el contenido de biomasa y en el área foliar, ya que este nutriente juega un papel importante en la morfogénesis y expansión foliar, lo cual permite una mejor captación de energía radiante [20]. En estudios similares realizados sobre la caracterización y evaluación de bacterias Pseudomonas fluoresces presentes en la rizósfera del maíz, se mostró que las plantas de maíz inoculadas con cepas de P. fluorescens, al absorber fósforo eficientemente, obtuvieron altos porcentajes de materia seca y área foliar con respecto al testigo absoluto [21].
Otros estudios realizados en el cultivo del arroz (Oriza sativa L), con el uso de cepas nativas de Azospirillum sp., reportaron un incremento significativo en la masa seca de la parte aérea, respecto al control absoluto, con índices de efectividad de 102,06 % (GM- 57); 88,24% (GM-86); 58,53% (GM-84) y 52,65% (GM-47) [22].
Sobre el análisis químico de N y P presentes en el suelo antes de la siembra y a la cosecha, los resultados podrían estar relacionados con el hecho de que el cultivo del maíz requiere para su desarrollo y producción cantidades importantes de nitrógeno (N), fósforo (P), potasio (K), calcio (Ca), magnesio (Mg), azufre (S) y en menor cantidad micronutrientes, los cuales son extraídos en su totalidad del suelo. Razón por la cual el (N) acumulado en el suelo disminuyó en un 69% al finalizar el experimento, ya que el (N) es absorbido y acumulado por la planta en pre y post floración [23].
Los resultados del análisis del contenido de fósforo en el suelo una vez finalizado el experimento muestran que los tratamientos (Azospirillum + Pseudomonasfluorescens) y el control químico (con N y P) aumentaron el contenido de fósforo, estos resultados podrían estar dados a la capacidad que tienen estos microorganismos solubilizadores de fosfato para reducir el pH mediante la secreción de diferentes tipos de ácidos, lo cual permite bajar el pH de la rizósfera y consecuentemente, disociar las formas de enlaces de fosfato que vuelven este elemento no asimilable, permitiendo que el fósforo disponible en el suelo aumente en los tratamientos inoculados a base de cepas P. fluorescens y A. sp [24]. Resultados similares fueron obtenidos en estudios realizados sobre la evaluación de bacterias Pseudomonas, solubilizadoras de fosfato, presentes en la rizósfera del maíz (Zea mays L.), encontrando un aumento de fósforo en un promedio de 18 ppm, para la mayoría de tratamientos. [21].
En el presente estudio, el suelo marcó un pH inicial de 6.5 y un pH final a la cosecha de 5.8. Estos resultados nos muestran que la actividad nitrogenasa de las cepas endófitas se favorecen cuando estas se cultivan a pH entre ácido y neutro (pH = 5-7) [25]. La mayor actividad nitrogenasa de estos organismos está asociada con el suelo rizosférico o con el interior de la raíz, presentando una variación estacional que en algunos casos coinciden con la etapa reproductiva de la planta [26]. Estos microorganismos son capaces de solubilizar más de 450 mg.ml-1 de fósforo en suelos con altas concentraciones de metales pesados y con condiciones de alta humedad y temperatura [24]. Inclusive, algunos biofertilizantes tienen la capacidad de solubilizar fosfato en suelos con altas concentraciones de agroquímicos. El contenido total de fósforo en los suelos es de 0.05%, y únicamente el 0.1% del total de fósforo está en forma disponible para las plantas, ya que la mayor parte está en forma insoluble como parte de fosfatos de calcio y hierro [27].
En cuanto a los porcentajes de N y P en el tejido foliar de plantas de maíz estos fueron mayores en las plantas inoculadas con los biofertilizantes con respecto a los controles (químico con N y P) y absoluto (sin inoculación). Estos resultados sugieren que las plantas inoculadas con algún microorganismo estimulan su crecimiento y desarrollo al presentar una mayor capacidad para absorber más eficientemente el agua y los nutrientes del suelo a través del estímulo provocado en el sistema radical, que se evidencia en el estado nutricional de las plantas [28].
Estudios similares sobre la evaluación del efecto de inoculación de Azospirillum sp. en el cultivo de maíz, muestran que las plantas presentaron un porcentaje de absorción de nitrógeno en el tejido foliar del 2.92% [29], mientras que la inoculación de A. brasilense y P. fluorescens incrementaron el contenido de fósforo total en 1698 kg. ha-1 sobre el testigo con 187 Kg. ha-1 [30].
Los resultados obtenidos en el presente estudio podrían atribuirse a que ambos géneros bacterianos tienen la capacidad de fijar nitrógeno y producir compuestos promotores del crecimiento vegetal (PGPR) [31]. Estos géneros bacterianos producen una generación y expansión del sistema foliar e incremento en la expansión radicular, permitiendo a las plantas promover su capacidad competitiva y de absorción de nutrientes del suelo el cual se ve reflejado en el contenido de nitrógeno absorbido por la planta de maíz variedad [32]. La absorción de fósforo y nitrógeno tiene una relación directa con la morfología de la planta es decir, que cuanto más fósforo y nitrógeno foliar fue tomado por las raíces de la planta, mejor es el desarrollo de su sistema foliar y radical [3]. En conclusión, la biofertilización a base de cepas Azospirillum sp y Pseudomonas fluorescens, solos o en combinación promovieron una mayor asimilación de contenidos de N y P en el tejido vegetal. Razón por la cual el uso de estos biofertilizantes puede ser una estrategia sostenible para complementar o reducir el uso de fertilizantes químicos e incrementar la productividad del maíz en la sierra del Ecuador.
Agradecimientos
Al Instituto Nacional de Investigaciones Agropecuarias INIAP- Programa de Maíz, (Estación Experimental Santa Catalina) por su valiosa colaboración en el establecimiento y gestión del experimento.
Referencias
Yánez, G.C., Zambrano Mendoza, J., Caicedo, M., & Heredia, J. (2013). Guía de producción de maíz de altura. Quito, Ecuador: INIAP, Estación Experimental Santa Catalina, Programa de Maíz. Guía N°. 96.
ESPAC. (2014). Visualizador de estadísticas agropecuarias del Ecuador ESPAC. Recuperado de http://www.ecuadorencifras.gob.ec/estadisticas-agropecuarias-2
Guzmán Estrada, E. A. (2012). Aislamiento y Caracterización de Bacterias Solubilizadoras de Fósforo a partir de cuatro suelos de la provincia de Chimborazo. Escuela Superior Politécnica de Chimborazo (Tesis de licenciatura). Riobamba, Ecuador.
Suquilanda, M. (2008). El deterioro de los suelos en el Ecuador y la producción agrícola. In XI Congreso Ecuatoriano de la Ciencia del Suelo. Recuperado de http://www.agrocalidad.gob.ec/revistaecuadorescalidad/index.php/revista/article/view/41/74
Bojórquez, A. D. A., Gutiérrez, C. G., Báez, J. R. C., Sánchez, M. Á. A., Montoya. Biofertlizantes en el desarrollo agrícola de México. Recuperado de http://uaim.edu.mx/webraximhai/Ej-16articulosPDF/07%20Biofertilizantes.pdf
Reyes, I. L., Álvarez, H., El-Ayoubi., & Valery, A. (2008). Selección y evaluación de rizobacterias promotoras del crecimiento en pimentón y maíz. Bioagro 20(1): 37- 48.
Ojeda-Quintana, L. J., Toledo-Vázquez, L., Hernández-Rodríguez, C., Machado-Díaz, Y., & Furrazola-Gómez, E. (2016). Influencia de la aplicación de Azospirillum lipoferum en Megathyrsus maximus vc. guinea tobiatá en un suelo Pardo Grisáceo. Pastos y Forrajes, 39(1), 27-32.
Fgaier, H., Eberl, H. J. (2010). A competition model between Pseudomonas fluorescens and pathogens via iron chelation. Journal of Theoretical Biology, 263(4), 566-578.
Martínez, R. Toledo, N., Arguelles, C. (2011). Introducción al conocimiento de los biofertilizantes. Universidad Tecnológica de la Huasteca Hidalguense, México.
Chaparro, J. M., Sheflin, A. M., Manter, D. K., & Vivanco, J. M. (2012). Manipulating the soil microbiome to increase soil health and plant fertility. Biology and Fertility of Soils, 48(5), 489-499.
Ferraris, G., & Faggioli, V. (2011). Inoculación con microorganismos con efecto promotor de crecimiento. Conocimientos actuales y experiencias realizadas en la Región Pampeana Argentina. Recuperado de http://agrolluvia.com/wp-content/uploads/2010/01/eea-marcosjuarez-fertilizantes-biologicos-en-maiz_5.pdf
Valverde, C., & Ferraris, G. (2009). Las Pseudomonas: un grupo heterogéneo con diversos mecanismos promotores del desarrollo vegetal. Uso actual y potencial de microorganismos para mejorar la nutrición y el desarrollo en trigo y maíz, 22-43. Recuperado de https://inta.gob.ar/sites/default/files/script-tmp-inta_microorganismos_trigo_maiz.pdf
Grageda-Cabrera, O. A., Díaz-Franco, A., Peña-Cabriales, J. J., & Vera-Núñez, J. A. (2012). Impacto de los biofertilizantes en la agricultura. Revista Mexicana de Ciencias Agrícolas, 3(6), 1261-1274.
Ruiz Nieves, Juan. (2015). Evaluación de cepas de (Azospirillum sp.) y mallas sombra de colores sobre la morfología y bioquímica de la lechuga. Recuperado de http://repositorio.uaaan.mx:8080/xmlui/handle/123456789/3998
Criollo, P. J., Obando, M., Sánchez, M., & Bonilla, R. (2012). Efecto de bacterias promotoras de crecimiento vegetal (PGPR) asociadas a Pennisetum clandestinum en el altiplano cundiboyacense. Corpoica Ciencia y Tecnología Agropecuaria, 13(2), 189-195.
Juárez, I. E. M. (2014). Evaluación de las cepas experimentales Azospirillum brasilense Az39 y Pseudomonas fluorescens Ps6 en el cultivo de maíz-ayuisrl. Recuperado de http://www.inoculantespalaversich.com/pdf/resultadosensayos-cultivomaiz-marcojuarez.pdf
Bremner, J. M. (1965). Total Nitrogen 1. Methods of soil analysis. Part 2. Chemical and microbiological properties, (methodsofsoilanb), 1149-1178.
Bashan, Y., & De-Bashan, L. E. (2010). How the plant growth-promoting bacterium Azospirillum promotes plant growth—a critical assessment. In Advances in agronomy Vol. 108, pp. 77-136.
De-Bashan, L. E., Hernández, J. P., & Bashan, Y. (2012). The potential contribution of plant growth-promoting bacteria to reduce environmental degradation-A comprehensive evaluation. Applied Soil Ecology, 61,171-189.
Parra, J., Ramírez, R., Lobo, D., Subero, N., & Sequera, O. (2011). Respuesta del maíz (Zea mays L.) en la etapa temprana a las formas de aplicación de fósforo. Rev. Fac. Agron, 37 (2), 86-92.
Pincay Verdezoto, A. K. (2014). Caracterización y evaluación de bacterias Pseudomonas sp. solubizadoras de fósforo presentes en la rizósfera del maíz (Zea mays) de los ensayos experimentales del INIAP de las provincias de Imbabura, Bolívar, Chimborazo y Pichincha. Escuela Politécnica del Ejército (Tesis de Ingeniería), Sangolquí, Ecuador.
García, F., Muñoz, H., Carreño, C., Mendoza, G. (2010). Caracterización de cepas nativas de Azospirillum spp. y su efecto en el desarrollo de Oryza sativa L.” arroz” en Lambayeque. Scientia Agropecuaria, 1(2), 107-116.
Echeverría, H. E. S. A., Echeverría, H. E. (1998). El rol del nitrógeno y del fósforo en la producción de maíz: diagnóstico de la fertilización nitrogenada y fosforada. Recuperado de http://msdssearch.dow.com/PublishedLiteratureDAS/dh_0032/0901b8038003272b.pdf?filepath=ar/pdfs/noreg/013-53003.pdf&fromPage=GetDoc
Misra, N., Gupta, G., Jha, P. N. (2012). Assessment of mineral phosphate solubilizing properties and molecular characterization of zinc tolerant bacteria. Journal of basic microbiology, 52(5), 549-558.
Aguilar Borja, M. B. (2015). Selección de bacterias de vida libre eficientes en fijación biológica de nitrógeno como alternativa sustentable para ecosistemas terrestres. Universidad Técnica de Ambato (Bachelor’s thesis), Ambato, Ecuador.
Marquina, M. E., Skwierinski, R. M., & Briceño, B. E. (2002). Actividad reductora de acetileno de bacterias asociadas a las Glumifloras del páramo Loma Redonda, MéridaVenezuela. Revista Pittieria, (31), 57-69.
Radzki, W., Mañero, F. G., Algar, E., García, J. L., García-Villaraco, A., & Solano, B. R. (2013). Bacterial siderophores efficiently provide iron to iron-starved tomato plants in hydroponics culture. Antonie Van Leeuwenhoek, 104(3), 321-330.
Rodríguez, V.M., dos Santos, S., Polon, V., Freitas, J.G., & Boller, P. A. Parada. (2005). Ocorrencia e efeito de bactérias diazotróficas em genotipos de trigo. Revista Brasileira de Ciencia do Solo 29: 345-352.
Ortiz Bustos, G. M. (2010). Evaluación del efecto de cuatro métodos de inoculación de dos cepas de Azospirillum spp., en el cultivo de maíz (Zea mays L.), variedades Iniap 122 y 102, en las provincias de Imbabura y Pichincha. Universidad Técnica de Ambato (Tesis de Ingenieria). Ambato, Ecuador.
Faggioli, V., Cazorla, C. R., Vigna, A., & Berti, M. F. (2003). Fertilizantes biológicos en maíz.: ensayo de inoculación con cepas de Azospirillum brasilense y Pseudomonas fluorescens. Instituto Nacional de Tecnología Agropecuaria. Recuperado de http://agrolluvia.com/wp-content/uploads/2010/01/eea-marcos-juarez-fertilizantes-biologicos-enmaiz_5.pdf
Aguirre-Medina, J. F., Moreno, J. A. E. (2016). Crecimiento y rendimiento de Capsicum annuum L. inoculado con endomicorriza y rizobacterias. Revista Mexicana de Ciencias Agrícolas, 7(7), 1539-1550.
Mohammadi, G. R. (2012). Phosphate Biofertilizer, Row Spacing and Plant Density Effects on Corn (Zea mays L.) Yield and Weed Growth. Recuperado de http://greenbiotech.se/wpcontent/uploads/2012/08/Phosphate-Biofertilizer-Row-Spacing-and-Plant-Density-Effects-on-Corn-Zea-mays-L.-Yield-and-Weed-Growth.pdf
Cárdenas Caro, D. M., Garrido Rubiano, M. F., Roncallo Fandiño, B. A., & Bonilla Buitrago, R. R. (2014). Inoculación con Azospirillum sppy Enterobacter aglomerans en pasto guinea (panicum maximum jacq.). Revista Facultad Nacional de Agronomía Medellín, Vol. 67, 2.
Información adicional
CONTRIBUCIONES DE LOS AUTORES: Carlos Sangoquiza concibió la investigación y
trabajo en la toma de datos, labores de campo, laboratorio, análisis
estadístico y redacción del manuscrito; Carlos Yánez, desarrolló la metodología
de la investigación, validación y verificación de los resultados; Misterbino
Borges, participó como tutor en la investigación así como en la revisión
crítica del contenido intelectual del manuscrito.