



Colorimetría mediante fotografía digital para la determinación de azul de metileno en experimentos de fotodegradación utilizando TiO2 como catalizador
Colorimetry through digital photography for the methylene blue determination in photodegradation experiments using TiO2 as catalyst
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
Recepción: 07 Febrero 2017
Aprobación: 30 Marzo 2017
Resumen: Los estudiantes de un curso de Química General realizaron medidas de absorbancia en disoluciones de diferente concentración de azul de metileno, por medio del análisis de color en fotografías de dichas disoluciones. Las medidas permitieron la construcción de una curva de calibración con un R2= 0,9904, que fue empleada en la determinación de la concentración del colorante en muestras de disolución expuestas a la luz solar en diferentes períodos para su degradación con TiO2, como catalizador. El método colorimétrico probado es fácil de usar y podría ser aplicado en laboratorios donde no se disponga un espectrofotómetro UV-Vis.
Palabras clave: colorimetría, azul de metileno, fotodegradación, Química General, Química Ambiental, TiO2.
Abstract: The students of a General Chemistry class made absorbance measurements in different concentration methylene blue solutions, through the color analysis of solutions pictures. They obtained a calibration curve with a R2=0.9904 that was used for the concentration determination of dye samples exposed to sunlight in variable degradation times with TiO2, as catalyst. The colorimetric method essayed is easy to use and it may be applied in laboratories where a UV-Vis spectrophotometer is not available.
Keywords: Colorimetry, methylene blue, photodegradation, General Chemistry, Enviromental Chemistry, TiO2.
Las determinaciones colorímétricas permiten hacer un análisis cuantitativo confiable de especies químicas que absorben radiación electromagnética ultravioleta y visible; por ejemplo, el análisis de hierro en una muestra de aqua o de colesterol en una muestra de sangre. También son importantes en el monitoreo de reacciones o procesos químicos, como la fotodegradación de azul de metileno catalizada con TiO2, que es un experimento que se ha utilizado para representar un método sostenible de purificación de aqua para estudiantes en cursos de Química General o de Ciencias Ambientales. En este experimento el azul de metileno representa un contaminante orgánico, que es removido por un sistema catalítico que utiliza la más renovable de todas las energías, la luz solar [1],
Para entender el rol del TiO2, en la degradación se parte de que este es un material semiconductor con un valor de banda prohibida (diferencia de energía entre la banda de valencia BV y la banda de conducción BC) de 388 nm o 3,195 eV. Cuando dicho material es irradiado con luz UV (hv) de la misma longitud de onda que su banda prohibida genera el par electrón/agujero [2]. El electrón en la BC (por reacción con el oxígeno) y el agujero en la BV (por reacción con el H2O) dan lugar a especies altamente reactivas que permiten la transformación del azul de metileno en productos incoloros (i.e. HCI, H2SO4, HNO3 y CO2). En la Fig. 1 se esquematiza el proceso redox que ocurre en las partículas deTiO2.
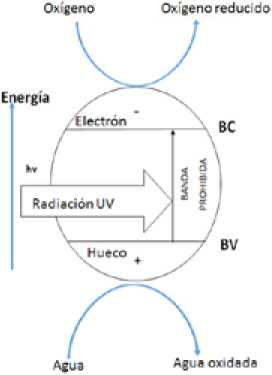
Representación esquemática de una partícula deTiO2 mostrando el par agujero (+)/electrón (-) en la capa de valencia BV y en capa de conducción BC respectivamente.
Cuando un compuesto orgánico se ha transformado en CO2 y ácidos minerales se considera que se ha degradado por completo (1) [3], Si bien los productos de reacción podrían parecer contaminantes, presentan menor toxicidad que el contaminante inicial. Se debe recalcar que la fotodegradación es un método que se utiliza para contaminantes que se encuentran en baja concentración (en el rango de los mg/L).
 (1)
(1)Para conocer la eficiencia de la degradación de azul de metileno es necesario determinar la concentración de este contaminante en diferentes períodos de exposición a una fuente de luz (radiación solar o lámpara UV). Para esto, generalmente se utiliza un espectrofotómetro UV-Vis, muchas veces ausente en un laboratorio de enseñanza básica. No obstante, en los últimos años se han utilizado cámaras digitales para realizar mediciones colorimétricas en diferentes tipos de experimentos como: la determinación de la concentración de colorantes [4] y nanopartículas de oro [5], y en experimentos de cinética química [6, 7].
Las imágenes tomadas por una cámara digital están compuestas por píxeles, los mismos que son la combinación de tres colores: rojo, verde y azul (RBG por sus siglas en inglés). Los valores de intensidad de estos colores en los píxeles están en una escala de 0 a 255 y son los que se usan como medida colorimétrica. Estos valores se pueden obtener por análisis de la fotografía utilizando el programa de procesamiento de imagen digital ImageJ que es un software libre. En este trabajo se presentan los resultados alcanzados por los estudiantes de un curso de Química General en la implementación del método de colorímetría mediante fotografía digital para un experimento de fotodegradación de azul de metileno catalizada porTiO2.
El experimento se dividió en 2 sesiones de 3 h cada una. En la primera de ellas se prepararon las disoluciones y se construyó la curva de calibración. En la segunda se hicieron los experimentos de degradación.
Preparación de las disoluciones:
Se pesó en una balanza analítica 43 mg de azul de metileno C16H18N3SCl.XH2O (95%, Lobal Chemie, x varía entre uno y dos; se utilizó un valor de x de 1,5 para realizar los cálculos) y se disolvieron en agua destilada (0,055 μs/cm; Barnstead Smart2Pure de Thermo Scientific) en un matraz aforado de 25 mL. La disolución resultante o “disolución madre” (d.m.) tuvo una concentración de 0,5 mM. Con diferentes volúmenes de d.m. (medidos con una micropipeta automática) se prepararon en matraces aforados 5 disoluciones estándar de 0,15 mM, 0,10 mM, 0,08 mM, 0,04 mM y 0,02 mM.
Construcción de las curvas de calibración:
Se llenaron 5 celdas para espectrofotometría UV-Vis con las 5 disoluciones estándar y una celda con agua destilada que sirvió como blanco. Se tomó una fotografía de todas las disoluciones al mismo tiempo con una cámara Cyber-Shot Sony ® con la máxima resolución (14,1 megapixeles) a 40 cm de distancia de la celda, en un lugar con baja exposición a la radiación solar. Con el programa Paint se recortó por triplicado un rectángulo de 120 x120 píxeles de cada fotografía correspondiente a cada concentración de azul de metileno y el blanco. En el programa ImageJ se pegó la imagen recortada, haciendo clic en la opción Paste, ubicada en el menú del botón Edit de la barra de herramientas. Para analizar la imagen se hizo clic en RGB Measure ubicado en el menú Analysis del botón Pluggins de la barra de herramientas. Al terminar este procedimiento, se abre una ventana con los valores promedio de la intensidad de los 3 colores rojo, verde y azul, que se copiaron en una hoja MS Excel. De cada concentración se tomaron 3 medidas de intensidad In, de la misma forma se tomaron 3 medidas de intensidad del blanco I0. A partir de la Ecuación 1 se calcularon las medidas de la absorbancia A (Tabla 1). Se hicieron las correspondientes curvas de calibración en una hoja de MS Excel para cada color, tomando a la concentración como variable independiente y a la absorbancia como variable dependiente.
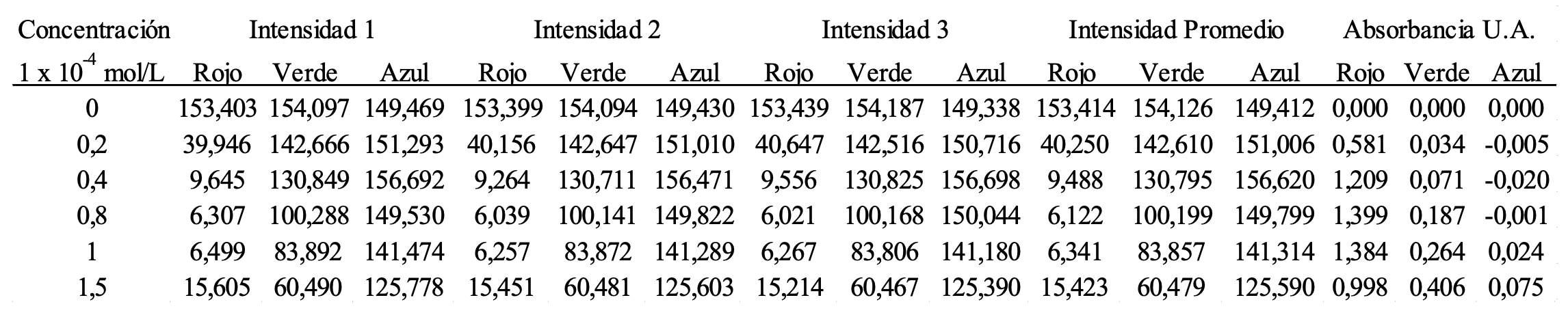
Datos de intensidad utilizados para la construcción de la curva de calibración
| Tiempo | Intensidad color verde | Absorbancia | A + 0,0205 , | C | |||
| (minutos) | 1 | 2 | 3 | Promedio | U.A. C | =---------------- (mM) 0,2784 k J | Co |
| 0,000 | 163,091 | 163,824 | 163,035 | 163,317 | 0,000 | 0,100 | 1,000 |
| 15,000 | 91,232 | 91,852 | 90,995 | 91,360 | 0,252 | 0,098 | 0,980 |
| 30,000 | 92,987 | 93,885 | 93,957 | 93,610 | 0,242 | 0,094 | 0,942 |
| 45,000 | 101,318 | 101,229 | 102,756 | 101,768 | 0,205 | 0,081 | 0,811 |
| 60,000 | 131,328 | 130,446 | 130,598 | 130,791 | 0,096 | 0,042 | 0,420 |
| 75,000 | 153,860 | 153,621 | 153,083 | 153,521 | 0,027 | 0,017 | 0,170 |
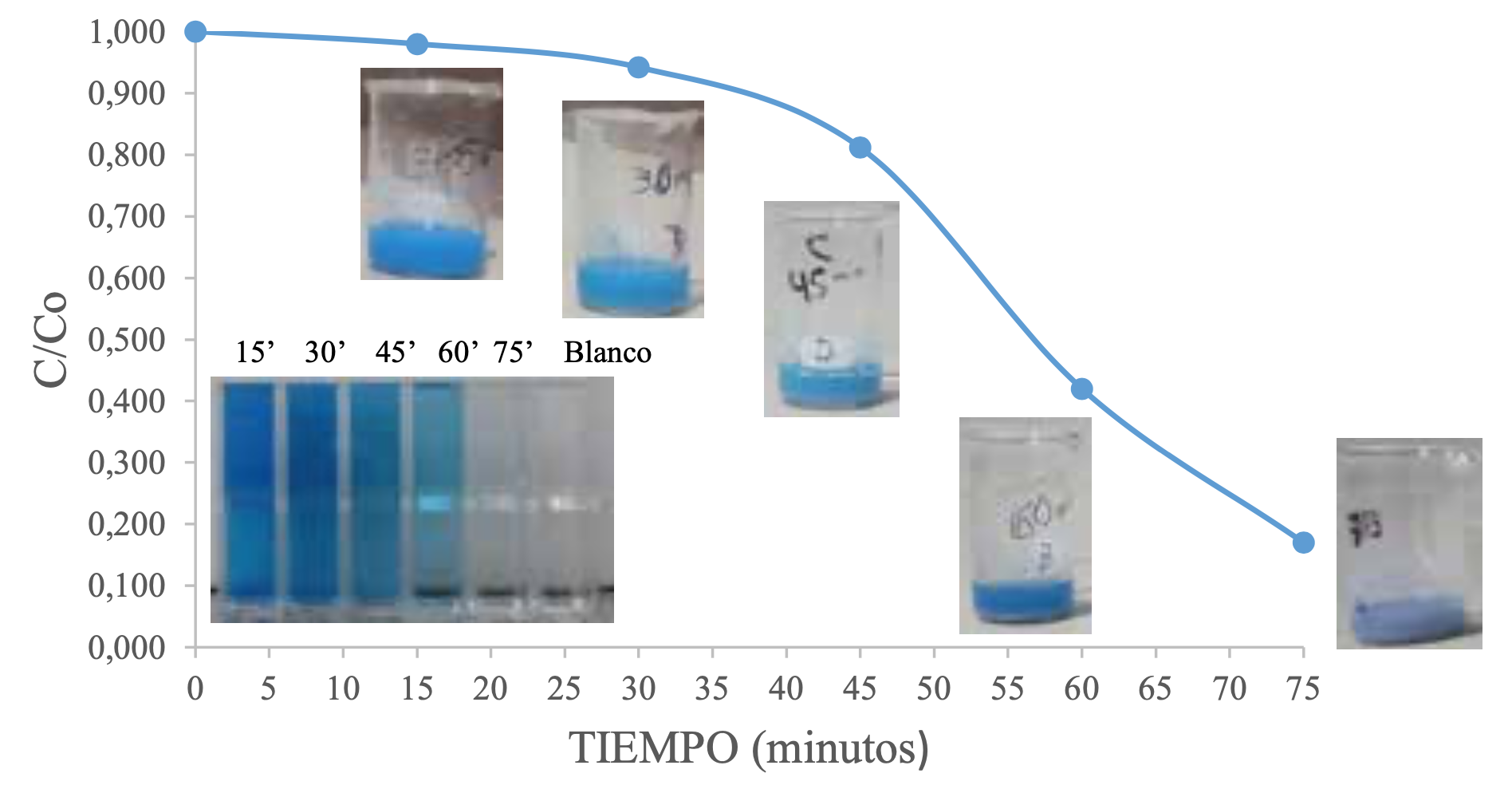
Fotodegradación de azul de metileno con TI02 como catalizador.
Fotodegradación de azul de metileno:
Se preparó 100 mL de una disolución 0,10 mM de azul de metileno en agua destilada. En 6 vasos de precipitación de 50 mL se colocaron 10 mL de esta disolución y 10 mg de dióxido de titanio (Anatasa, 99 %, tamaño de partícula > 25 nm, Aldrich). Los vasos se envolvieron con papel aluminio para protegerlos de la luz. Los experimentos de degradación se llevaron a cabo al medio día (12h00) en un día despejado (Insolación global en Tena, mes de septiembre: 5250 Wh/m2/día [8]) Cada disolución se expuso por un tiempo diferente a la radiación solar, cada una con 15 min de diferencia hasta completar 75 min. A continuación, se centrifugó cada disolución a 3000 rpm durante 5 min para separar y recuperar el óxido de titanio. Las disoluciones resultantes se colocaron en celdas y se tomó una fotografía de todas las muestras al mismo tiempo. Se procedió al análisis del color verde en la fotografía siguiendo el procedimiento descrito anteriormente. Con los valores de absorbancia se determinó la concentración de azul de metileno a diferentes períodos de exposición (Tabla 2).
La determinación de absorbancia, por medición de la intensidad de colores a partir del análisis RGB de la fotografía de las disoluciones de azul de metileno a varias concentraciones, permitió la construcción de las curvas de calibración para cada color (Figura 2). Los indicadores de linealidad R2 y proximidad a cero de la ordenada al origen [9] se utilizaron como indicadores de linealidad para determinar la mejor curva de calibración.
La curva del color rojo presenta las medidas de absorbancia más altas (Tabla 1), lo que está en concordancia con el máximo de absorbancia del azul metileno en 660 nm [2]. Sin embargo, con el color rojo no se alcanza la linealidad para todos los puntos de la curva. Pero, los puntos correspondientes al blanco y las concentraciones de 0,2 y 0,4 mM se ajustan a una línea recta con un R2=0,9995. Esto indica que el análisis de la intensidad del color rojo puede ser útil para la determinación de azul de metileno en muestras con concentración < 0,8 mM.
La curva de calibración del color azul muestra las medidas de absorbancia más pequeñas (Tabla 1). Para las concentraciones de 0,2; 0,4 y 0,8 mM, los valores de absorbancia son de igual de magnitud que el blanco (Tabla 2). Al realizar una curva de calibración con las disoluciones 0; 1,0 y 1,5 mM tampoco se alcanza linealidad. La respuesta analítica con este color no es atractiva para realizar determinaciones colorimétricas de azul de metileno mediante fotografía digital.
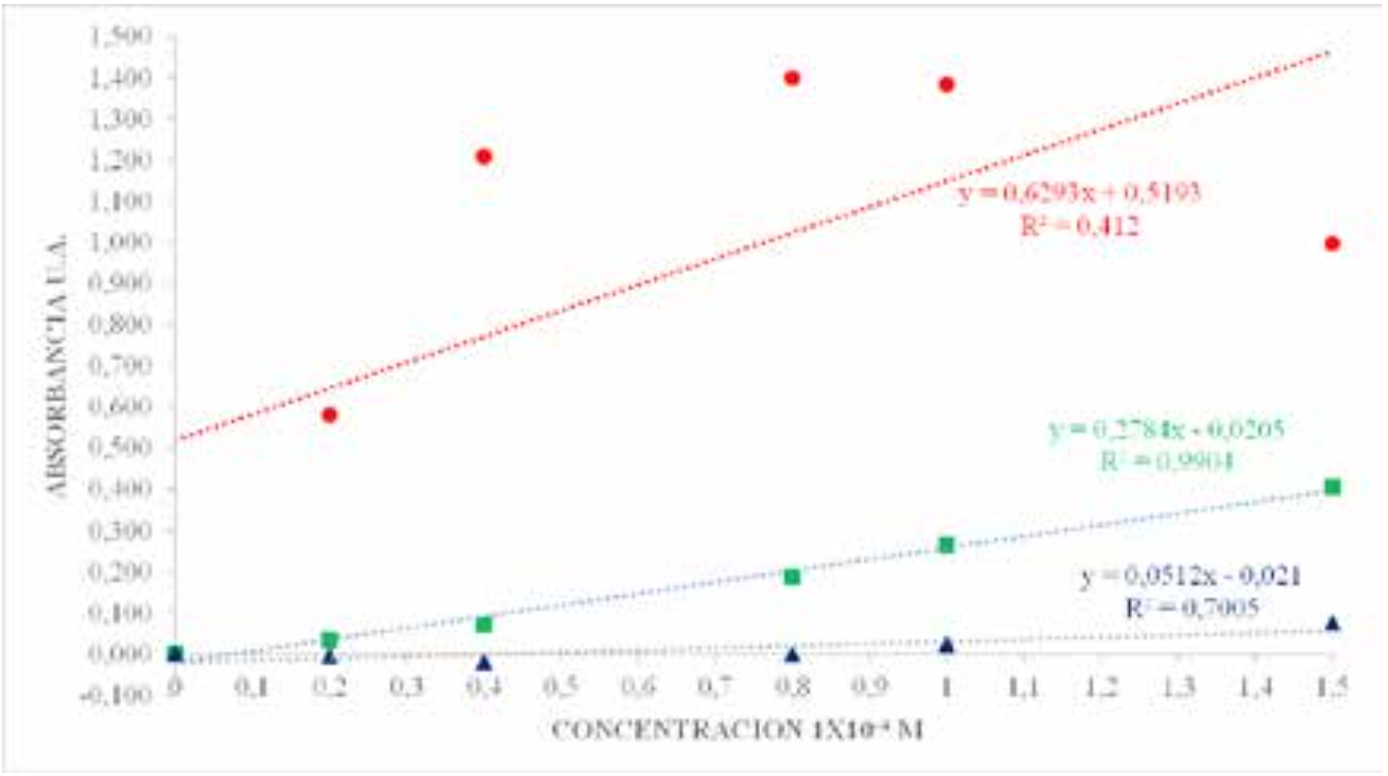
Curvas de calibración de azul de metileno utilizando el análisis de fotografías RGB. Círculos (usando el color rojo) cuadrados (usando el color verde), triángulos (usando el color azul).
La curva de calibración para el color verde se ajusta a una línea recta en todo el rango de concentraciones (0 a 1,5 mM) con R2 = 0,9904. Además, la ordenada al origen de esta curva es muy cercana a cero. Esta curva de calibración fue utilizada para determinar la concentración de azul de metileno en el experimento de degradación.
Como se mencionó anteriormente, el máximo de absorbancia del azul de metileno corresponde al color rojo del visible. Esto significa que el color que apreciará el observador será el color complementario al rojo [10] que es el color cian, una mezcla de azul y verde, esto de acuerdo a la teoría del color [11]. El componente verde en el color de las disoluciones fue el más sensible a los cambios de concentración y por esto se alcanzan los mejores resultados. Es importante, que el análisis de color se realice con fotografías de alta resolución, debido a que se deben analizar en la misma fotografía todas las concentraciones de la curva de calibración [4].
Para los experimentos de fotodegradación fue importante considerar el área de iluminación solar recibida por las disoluciones. Algunos experimentos preliminares que se llevaron a cabo en tubos de ensayo tuvieron un área pequeña sometida a iluminación directa (el área circular del tubo), en donde no se observó mayor degradación a pesar de haber sido iluminadas por más de una hora. El proceso de fotodegradación con TiO2 en disoluciones acuosas se da muy cerca de la superficie del catalizador [3]. Además, se considera que el proceso es trifásico (acuoso, sólido y luz); por lo tanto, para favorecer el proceso de fotodegradación es necesario utilizar capas delgadas de TiO2 que tengan una exposición directa a la luz UV, lo que demanda áreas de iluminación relativamente grandes [12]. En nuestro experimento logramos estas condiciones cuando se llevó a cabo en vasos de precipitación. Otro factor responsable de la baja fotodegradación de azul de metileno podría ser la absorción de radiación ultravioleta por parte del vidrio.
Cuando el experimento se realizó en vasos de precipitación se observó que existe una relación inversamente proporcional (no lineal) entre el tiempo de exposición y la concentración de azul de metileno, es decir, a mayor tiempo de exposición existe una mayor degradación del colorante (Figura 3). La curva de fotodegradación muestra que en los primeros 30 minutos este proceso transcurre lentamente, alcanzando menos del 10% de degradación. A partir del minuto 45 el proceso es más rápido y varía de manera casi lineal hasta el minuto 75, momento en el que se detuvo el experimento. Se alcanzó una degradación del 83% con respecto a la concentración inicial de azul de metileno luego de 75 minutos de exposición a luz solar.
Existe una relación lineal entre la absorbancia obtenida a partir de valores de intensidad del color verde en fotografías digitales de disoluciones de azul de metileno y sus concentraciones, en un rango entre 0 y 1,5 mM. El método de colorimetría mediante fotografía digital es útil y fácil para monitorear la reacción de fotodegradación de azul de metileno, catalizada con TiO2. Este experimento podría llevarse a cabo con alumnos de un curso de Química: General, Analítica o Ambiental.
Fotodegradación de azul de metileno con TiO2.
Agradecimientos
A la Universidad Regional Amazónica Ikiam por el financiamiento para este proyecto. A la Dra. Ibeth N. Rendón-Enríguez por sus valiosos comentarios durante la preparación de este artículo.
Referencias
Au brecht, K. B., Pawda, L, Shen,X., & Bazargan, G. (2015). Development and Implementation ota Series of Laboratory Field Trips for Advanced High School Students To Connect Chemistry to Sustainability. Journal of Chemical Education, 92 (4), 631-637. doi: http://pubs.acs.org/doi/pdf/10.1021/ed500630f
Nogueira, R. F. P, & Jardim, W. F. (1993). Photodegradation of Methylene Blue Using Solar Light and Semiconductor (Ti02). Journal of Chemical Education 70 (10), 861-862. doi: http://pubs.acs.org/doi/pdf/10.1021/ed070p861
Xu, C, Rangaiah, G. R, & Zhao, X. S. (2014). Photocatalytic Degradation of Methylene Blue by Titanium Dioxide: Experimental and Modeling Study. Industrial & Engineering Chemistry Research, 53 (38), 14641-14649. doi: http://pubs.acs.org/doi/pdf/10.1021/ie502367x
Kehoe, E., & Penn, R. L. (2013). Introducing Colorimetric Analysis with Camera Phonesand Digital Cameras: An Activity for High School or General Chemistry. Journal of Chemical Education, 90 (9), 1191-1195. doi: http://pubs.acs.org/doi/pdf/10.1021/ed300567p
Campos, A. R., Knutson, C. M, Knutson, T. R., Mozzetti, A. R., Haynes, C. L, & Penn, R. L. (2016). Quantifying Gold Nanoparticle Concentration in a Dietary Supplement Using Smartphone Colorimetry and Google Applications. Journal of Chemical Education, 93 (2), 318-321. doi: http://pubs.acs.org/doi/pdf/10.1021/acs.jchemed.5b00385
Knutson, T. R., Knutson, C. M., Mozzetti, A. R., Campos, A. R., Haynes, C. L, & Penn, R. L. (2015). A Fresh Look at the CrystalViolet Lab with Handheld Camera Colorimetry. Journal of Chemical Education, 92 (10), 1692-1695. doi: http://pubs.acs.org/doi/pdf/10.1021/ed500876y
Moraes, E. P., Confessor, M. R., & Gasparotto L. H. S. (2015). Integrating Mobile Phones into Science Teaching To Help Students Develop a Procedure To Evaluate the Corrosion Rate of Iron in Simulated Seawater. Journal of Chemical Education, 92 (10), 1696-1699. doi: http://pubs.acs.org/doi/abs/10.1021/acs.jchemed.5b00274
Corporación para Investigación Energética (2008). Atlas Solar del Ecuador con fines de Generación Eléctrica. Quito: Consejo Nacional de Electricidad.
Harris, D.C. (2007). Análisis Químico Cuantitativo 3a edición. Barcelona: Reverte
Williams, D. R., Flaherty, T.J., Jupe, C.L., Coleman, S.A., Marquez, K.A., & Stanton, JJ. (2007). Beyond λ max: Transforming Visible Spectra into 24-bit Color Values. Journal of Chemical Education, 84 (11), 1873-1877. doi: http://pubs.acs.org/doi/pdf/10.1021/ed084p1873
Adobe ®. Technical Guides, Color models, consultada en octubre 27, 2016 en la URL: http://dba.med.sc.edu/price/irf/Adobe_tg/models/rgbcmy.html
Alexiadis, A.,& Mazzarino, I. (2005). Design guidelines for fixed-bed photocatalytic reactors. Chemical Engineering and Processing 44 (4), 453-459. doi: http://dx.doi.Org/10.1016/j.cep.2004.06.009
Información adicional
Contribuciones de los autores:
:
Pablo A. Cisneros Pérez realizó la redacción, concepción y diseño del trabajo; Ángel S.
Intriago-Mendoza y Jean P. Ramos-Galarza participaron en la adquisición y análisis de
los datos del trabajo.