



Incidencia de la pesca artesanal en la riqueza y composición ictiológica en lagunas de la Amazonía central del Ecuador
Incidence of artisanal fisheries on the ichthyological richness and composition Importar imagen of lagoons in central Amazonia of Ecuador
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
Recepción: 02 Agosto 2016
Aprobación: 09 Julio 2018
Resumen: El objetivo de esta investigación fue caracterizar la composición de la comunidad de peces de ocho lagunas de la Amazonía central del Ecuador, durante la temporada seca del año 2011. Se estudió la incidencia de la pesca artesanal kichwa sobre la riqueza, abundancia, composición, biomasa, tamaño y captura por unidad de esfuerzo (CPUE) entre cuatro lagunas de pesca artesanal intensiva y cuatro lagunas protegidas. El muestreo de peces se realizó empleando técnicas ancestrales de pesca kichwa. Una vez que los peces fueron capturados, se identificaron, midieron y pesaron. Se estimó la diversidad alfa de cada laguna y se compararon las comunidades de peces entre las lagunas con pesca intensiva y las lagunas protegidas. La riqueza de peces, la abundancia, la biomasa, el tamaño y la CPUE se contrastaron entre ambos tipos de lagunas usando estadística no paramétrica. Nuestros resultados muestran que, independientemente de los efectos de la pesca, los Characiformes y Siluriformes son el grupo más numeroso, con Potamorhina latior, Psectrogaster amazonica y Triportheus elongatus como las especies más abundantes. Algunas especies como Serrasalmus rhombeusfueron frecuentes en lagunas protegidas, mientras que Steindachnerina bimaculata fue dominante en lagunas bajo pesca intensiva. Únicamente se detectó una variación estadísticamente significativa en la talla media de los peces entre lagunas de pesca intensiva respecto de las protegidas en este estudio inicial. Con base en nuestros resultados, sugerimos que se desarrollen nuevos programas de monitoreo para promover la regulación de la pesca y los aparejos utilizados en consenso con los pescadores kichwa, para garantizar la conservación de la biodiversidad local y la mantención de la soberanía alimentaria.
Palabras clave: Composición y abundancia, peces lacustres, pesca artesanal, talla media, lagunas de inundación.
Abstract: The aim of this research was to characterize the fish composition from eight lagoons from the western Amazon in Ecuador. During the dry season of 2011, we studied the derived effects of the kichwa artisanal fishing on fish richness, abundance, community composition, biomass, size, and catch per unit effort (CPUE) between four lagoons of intensive artisanal fishing and four protected lagoons. Fish sampling was conducted employing ancestral kichwa fishing techniques. Once fish were captured, they were identified, measured and weighed. We estimated alpha diversity of each lagoon and we further compared fish assemblages between intensive fishing and protected lagoons. Fish richness, abundance, biomass, size and CPUE were compared between both types of lagoons using nonparametric statistics. Our results show that, regardless the effects of fishing, Characiformes and Siluriformes are the most numerous group, with Potamorhina latior, Psectrogaster amazonica and Triportheus elongatusas the most abundant species. Some species like Serrasalmus rhombeus were prevalent in protected lagoons whereas Steindachnerina bimaculata was prevalent in lagoons under intensive fishing. Only fish mean-size showed a significant difference as more adults individuals were sampled in protected lagoons. In conclusion, the studied lagoons have an important species richness. However, local fishing has generated an initial change in the dominance of bentivorous and carnivore species. Based on our results we suggest that new monitoring programs should be developed in order to promote the regulation of fishing to ensure the conservation of local biodiversity and to maintain food availability.
Keywords: Composition, abundance, lacustrine fish, fishing, medium size, flooded lagoons.
INTRODUCCIÓN
Los ríos tropicales y sus planicies inundables contienen una proporción significativa de la biodiversidad mundial y proveen importantes bienes y servicios ecológicos a la sociedad [1,2]. Múltiples estudios ictiológicos confirman que las planicies inundables amazónicas presentan comunidades diversas y abundantes de peces dulceacuícolas [3], con un estimado de riqueza de hasta 3000 especies [4-6].
En las grandes cuencas hidrográficas tropicales, el origen y alta diversidad de la fauna fluvial se deben a la existencia de los hábitats de la planicie inundable [7]. Hábitats tales como las lagunas y el bosque inundado son ecosistemas importantes para el desarrollo, alimentación y reproducción de muchas especies de peces sedentarios y migratorios [5,8]. En sincronía con las inundaciones estacionales, los peces migran desde los grandes ríos, hacia las lagunas adyacentes y al bosque ripario para cumplir con su ciclo vital. Esto hace que pesquerías de alto valor económico y social se localicen en estos ambientes [9].
Las lagunas de la planicie inundable son hábitats acuáticos de poca profundidad que mantienen una conexión estacional con un río adyacente mediante un canal [4,10]. Estas lagunas se originan a partir de meandros antiguos de un río que, según su cercanía, influencia estacionalmente su caudal en mayor o menor incidencia [8,11]. En la Amazonía occidental, debido a los ríos meándricos, se forma una mayor proporción de estas lagunas conocidas como lagunas “oxbow” o de herradura, por su forma característica [10]. Las lagunas oxbow jóvenes se localizan más cerca del canal principal del río y tienen una similitud morfológica con el mismo. Esta similitud cambia con el paso del tiempo, ya que por el depósito de sedimentos y una mayor presencia de materia vegetal, su profundidad disminuye [11]. Estudios previos indican que las lagunas menos profundas suelen ser más productivas y diversas [12].
Las lagunas de la planicie amazónica son sitios clave para la crianza, alimentación y reproducción de muchas especies de peces. Larvas y alevines de muchas especies de peces carácidos y curimátidos (Characidae y Curimatidae) usan estos ambientes como zonas de cría, ya que ofrecen mejores condiciones de protección contra predadores y mayor disponibilidad de alimentos [13]. Otras especies como los bagres pimelódidos (Pimelodidae) retornan a estos hábitats luego de desovar en los ríos adyacentes [8]. En todos los biomas tropicales, las lagunas son hábitats indispensables para el cumplimiento de los ciclos reproductivos de peces y la mantención de sus poblaciones [14].
En el verano, el bajo nivel del caudal de los ríos reduce el volumen de las lagunas provocando una mayor concentración en número de individuos, particularmente de especies de las familias Pimelodidae, Cichlidae, Curimatidae, Serrasalmidae, y de otras especies sedentarias y migratorias [15-17]. Mientras que en el invierno, las lagunas se interconectan con el bosque inundado, facilitando una elevada dispersión de los peces en un amplio rango de hábitats aledaños al espejo de agua [11].
Las lagunas tropicales tienen una notable importancia como sitios de emplazamiento de grandes pesquerías que producen alimento, ingresos y empleo para millones de personas [9,18-20]. En la Amazonía, la pesca en estos ambientes data desde hace más de 400 años, y ha generado alimento e ingresos económicos para la población local de toda la cuenca [21-24].
La pesca artesanal lacustre como actividad familiar se caracteriza por ser multi-aparejo, multi-específica y estacional. En la época de verano las lagunas amazónicas o cuchas son las localidades más importantes para la pesca ya que los peces quedan atrapados en sitios más reducidos y están más concentrados [17, 22, 25]. Los grupos de peces de mayor captura en las lagunas amazónicas son los curimátidos, carácidos, anostómidos, loricáridos, pimelódidos, cíclidos y el paiche Arapaima gigas [15, 21, 26, 27]. Durante el invierno, el agua inunda los ambientes, facilitando la dispersión de los peces, lo que disminuye la oferta de pescado disponible para la gente [15].
Actualmente, el incremento de la intensidad de la pesca en toda la cuenca amazónica genera mayores impactos en la diversidad y ecología de las lagunas de la planicie inundable [21]. En estos ambientes, la pesca intensiva incide inicialmente en las especies piscívoras de mayor talla con lo que se afecta la abundancia de todas las especies y la estructura de las cadenas tróficas. En consecuencia, la captura luego es dirigida hacia otras especies detritívoras y omnívoras de menor tamaño [28]. El efecto de la pesca intensiva puede causar un gran impacto en las poblaciones de peces y en el caso de una especie aislada en un ambiente léntico, inclusive podría causar su extinción [29]. Desde un contexto social, la reducción paulatina de las capturas en las lagunas genera un incremento de los conflictos, enfrentamientos e inclusive violencia entre los pescadores locales [30].
La pesca artesanal o de pequeña escala aporta con más de la mitad de la captura mundial de peces para el consumo humano y es realizada por una abrumadora mayoría de pescadores existentes en todo el neotrópico [31]. A pesar de su importancia y efectos, aún no hay información suficiente sobre pesquerías artesanales lacustres amazónicas para promover un manejo sostenible [29]. Algunas especies de peces de mayor importancia comercial han sido estudiadas pero existen grandes vacíos en el conocimiento de los peces lacustres [30]. Tampoco hay estudios comparativos suficientes que permitan evaluar el éxito de la aplicación de medidas regulatorias de pesca en lagunas amazónicas, como modelos que podrían replicarse en otros lugares de la región para efectos de conservación[8]. Los estudios iniciales sobre los efectos de la pesca lacustre tropical en los ensambles de peces han producido resultados divergentes [12, 18, 32, 33], lo cual sugiere la necesidad derealizar nuevas investigaciones para incrementar el conocimiento sobre la dinámica de lapesca artesanal y sus efectos en las comunidades de peces [27, 34, 35]. Particularmente para la amazonia ecuatoriana, estudios tendientes a caracterizar las comunidades de peces lacustres y medir los efectos de la pesca artesanal lacustre son aún muy incipientes.
Para las comunidades kichwa de la Amazonía central ecuatoriana, la pesca artesanal en el canal principal del río Curaray y en sus lagunas adyacentes es la principal actividad para el sustento familiar y la obtención de ingresos. En dichas actividades se registran más de 80 especies de peces lacustres [36-38]. En los últimos años las familias kichwa de esta zona han detectado una disminución en los stocks de peces lacustres en sus áreas de pesca. Para las comunidades esta reducción puede ser producto de un creciente aumento de la pesca artesanal con fines de uso comercial, por lo cual el presente estudio se planteó con los siguientes objetivos:
Caracterizar la composición de una comunidad de peces de ocho lagunas de inundación localizadas en un sector de la cuenca baja del río Curaray, durante la época de verano (aguas bajas).
Comparar la riqueza, abundancia, composición de la comunidad, talla, peso y Captura por Unidad de Esfuerzo (CPUE) de los peces de lagunas bajo pesca artesanal intensiva versus lagunas protegidas.
MATERIALES Y MÉTODOS
Área de estudio
Los datos fueron obtenidos de ocho lagunas bajo dos diferentes tipos de manejo, ubicadas en la Amazonía central de Ecuador (Fig. 1) durante el mes de septiembre del año 2011, correspondiente a la época de aguas bajas. Según su clasificación hidrológica, las lagunas estudiadas se catalogan como lagunas abiertas de la planicie inundable [4,10]. Este tipo de lagunas mantiene un canal estrecho de conexión a un río que las alimenta estacionalmente. Todas las lagunas analizadas comparten un origen similar al haberse formado a partir de meandros antiguos del río Curaray. El río Curaray es un ecosistema acuático de alta importancia en la amazonia central de Ecuador por su notable extensión, caudal, y biodiversidad L. Guarderas et. al. (datos sin publicar). Por su origen a partir de la cordillera oriental y otras características físico-químicas, este río se clasifica como un típico río de aguas blancas [37]. Por su zoogeografía, la cuenca del Curaray pertenece al Piso Tropical Oriental [39].
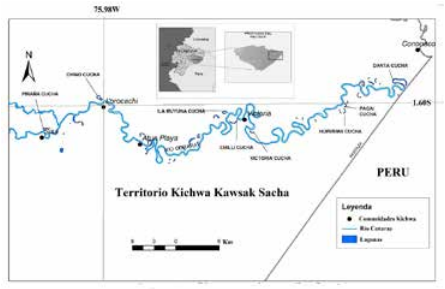
Mapa del área de estudio
Las lagunas estudiadas se localizaron en un tramo de 50 km de distancia, a lo largo de la cuenca baja del río Curaray, en las inmediaciones de tres comunidades kichwa: Sisa (76.065444W – 1.612972S), Lorocachi (75.988667W – 1.608306S) y Victoria (75.858194W – 1.624028S), usando como referencia el Sistema Geodésico Mundial 1984 (WGS84) 17S, a una altura de 230 metros sobre el nivel del mar. Estas tres comunidades indígenas pertenecen al Territorio del Pueblo Ancestral Kichwa Kawsak Sacha, ubicado en la parroquia Curaray, cantón Arajuno, provincia de Pastaza.
El área de estudio presenta especies vegetales características del Bosque Siempre Verde de Tierras Bajas de la Amazonía. La flora de las orillas de las lagunas incluye especies características del Bosque Siempreverde de tierras bajas inundable por aguas blancas como el Yutsu (Calliandra sp.) y el Tsila Dundu (Cecropia sp.) y del Bosque inundablede palmas de tierras bajas como el morete (Mauritia flexuosa) y la shiona (Euterpe precatoria) [40]. El bosque inundable que rodea a todas las lagunas estudiadas está en buenas condiciones de conservación, sin encontrarse evidencia de claros con fines de agricultura o tala de madera.
El clima de la zona es Húmedo Tropical, con temperaturas de 23 a 25.5°C y una precipitación anual de 2000 a 3000 mm [41]. El verano o época de aguas bajas en la zona va de agosto a diciembre, mientras que el invierno o época de aguas altas corresponde a los meses de febrero a junio.
Las comunidades kichwa de Sisa, Victoria y Lorocachi se componen de seis, siete y 26 familias respectivamente (29, 38 y 151 habitantes). Todas las comunidades tienen como principales actividades productivas la pesca artesanal, cacería, agricultura y recolección de productos forestales maderables y no maderables [38].
El estudio contó con la autorización de investigación científica N. 08-IC-FAU-DPPZ/MA emitida por la Dirección Provincial de Pastaza, del Ministerio del Ambiente.
Muestreo de peces lacustres
El muestreo de peces de las ocho lagunas se hizo mediante técnicas tradicionales de pesca, con la participación de pescadores kichwa locales. La catalogación del tipo de manejo de las lagunas (Tabla 1) en este estudio se realizó bajo dos categorías: las lagunas de pesca artesanal intensiva, consideradas aquellas que están localizadas muy cerca de las poblaciones kichwa del área y que tradicionalmente han sido objeto de actividades familiares de pesca, con una frecuencia diaria y semanal, desde el establecimiento de las comunidades en la zona. En estas lagunas se usan cotidianamente diferentes aparejos de pesca (redes, anzuelos, líneas, atarrayas y arpones) y se emplean canoas a motor y remo. Parte de la captura de estas lagunas se destina para el comercio local y regional.
| Laguna UbicaciónGeográfica Tipo de laguna por su manejo Piraña Cucha 76°3´37.4W - 1°38´15.2S Pesca intensiva Chino Cucha 75°59´42.1W - 1°35´58.8S Pesca intensiva Ila Muyuna Cucha 75°50´18.2W - 1°37´4.6S Pesca intensiva Chilli Cucha 75°49´53.9W - 1°37´51.2S Pesca intensiva Victoria Cucha 75°48´15.9W - 1°38´37.4S Protegida Huririma Cucha 75°41´29.7W - 1°36´48.7S Protegida Pacai Cucha 75°41´27.1W - 1°36´40.2S Protegida Danta cucha 75°36´52.7W - 1°34´52.2S Protegida |
Localidades de muestreo.
Como lagunas protegidas se consideraron a aquellas en donde las actividades de pesca artesanal son raras durante el año. Esto es debido a las dificultades logísticas de acceso dada su ubicación más distante a los poblados kichwa y por la ausencia de pasos de entrada adecuados para las canoas a motor o remo desde el río. En estas lagunas únicamente el personal de guardabosques comunitarios pesca con anzuelos individuales, para su autosubsistencia, mientras realizan sus patrullajes.
Cada laguna fue considerada como una localidad. En cada una fueron seleccionados al azar tres sectores de muestreo (zona cercana al canal de contacto con el río, zona media de la laguna y zona de cabecera). En cada sector, el muestreo de peces se hizo con el uso simultáneo de tres redes agalleras de nylon fishing Net & Twine, tres líneas de anzuelos (conocidas localmente como calandras) y atarraya durante dos horas de pesca, en el caso de la atarraya se realizaron 20 lanzamientos. La colocación de las redes y líneas siempre se realizó de forma perpendicular a las orillas de los lagos. Las pescas se realizaron bajo condiciones climáticas similares.
Los peces fueron colectados durante un día en cada laguna, en tres horarios de pesca de dos horas: 08h00 a 10h00, de 15h00 a 17h00y de 20h00 a 22h00. La pesca en cada sector de muestreo se efectuó únicamente en uno de los tres horarios pre-definidos. En total, para cada localidad se realizó un esfuerzo de pesca de seis horas (dos horas por sector por tres sectores por cada localidad). Para cada localidad se realizó el registro de su ubicación geográfica, pH, Oxígeno Disuelto y temperatura del agua. La medición de los parámetros físico-químicos se realizó con un pHmetro Hanna HI98103 y un medidor YSI 550a.
Para la identificación de los especímenes se utilizaron las siguientes referencias bibliográficas, claves y catálogos ictiológicos relevantes para esta región [37, 42- 51]. Los especímenes colectados están depositados en la colección ictiológica del Museo Ecuatoriano de Ciencias Naturales (MECN), de Quito.
Análisis de datos
Se realizó una curva de acumulación de especies, como una medida de evaluación de la completitud del inventario lograda [52]. La curva representa la aparición de especies en las unidades de muestreo según el incremento en el número de individuos colectados e indica el nivel de eficiencia del muestreo [53, 54]. Se hizo la curva de acumulación de especies usando los datos agregados de los ocho lagos con el programa StimateS 8.2.0 [55] y desagregados por el factor de manejo establecido. Se calculó el estimador no paramétrico de riqueza CHAO 1, por ser de mayor rigurosidad.
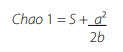
Donde, S es el número de especies en una muestra, a número de especies que están representadas solamente por un único individuo en la muestra y b es el número de especies representadas por dos individuos en la muestra [52].
Para cuantificar la diversidad alfa lacustre se usó como índice directo a la riqueza de especies como número de especies por sitio de muestreo [54]. La riqueza de especies obtenida en cada uno de los tres sectores de cada localidad analizada fue combinada para obtener un valor de riqueza total por cada localidad. Por lo tanto, cada localidad fue considerada como una unidad de muestra [56].
Para comparar la composición, abundancia y la uniformidad de especies entre lagunas de pesca intensiva y lagunas protegidas se elaboraron curvas de dominancia / diversidad. Estas curvas también conocidas como gráficos rango-abundancia, permiten graficar las especies secuencialmente de mayor a menor abundancia (eje X) y el logaritmo de sus respectivas abundancias, (eje Y) [53, 57-59]. El análisis de estas curvas permite observar el contraste de la riqueza de las comunidades, la dominancia de especies y la identificación de especies raras [60]. Además, es un método efectivo para visualizar cambios sucesionales y realizar seguimientos a impactos ambientales [53].
La diversidad beta indica el grado de recambio de especies y se evalúa considerando proporciones o diferencias evaluadas mediante índices que indican que tan similares/ disímiles son dos comunidades o muestras [54]. Para el cálculo de diversidad se usó el índice de Bray-Curtis (Índice Cuantitativo de Sorensen) como medida de la similitud/disimilitud para datos cuantitativos [53] considerando las muestras desagregadas por el factor de manejo. Este índice considera las abundancias de las especies compartidas [52]. Para el cálculo de la diversidad beta se usó el software EstimateS [55].
Para identificar posibles efectos de la pesca artesanal en la comunidad de peces lacustres se compararon variables biológicas que podrían verse afectadas por la pesca. Estas variables fueron comparadas entre las lagunas bajo pesca intensiva y las lagunas protegidas mediante la prueba no paramétrica U de Mann-Withney [33]. Las variables biológicas seleccionadas para la comparación entre los dos tipos de lagunas fueron la riqueza de especies, abundancia, biomasa, talla y captura por unidad de esfuerzo para redes. Estas variables, como probables indicadoras de la intensidad de la pesca, fueron escogidas en base a estudios previos realizados en áreas tropicales [12, 35, 61-65]. Los valores de abundancia y biomasa de cada localidad fueron estandarizados en número de peces/ hora y kilogramos/ hora, respectivamente. La medida de talla de los pecesempleada fue el largo estándar medio obtenido para cada localidad [33]. La captura por unidad de esfuerzo (CPUE) fue calculada en peces por m² de red por 1 hora y kg. por m² de red por 1 hora para cada una de las ocho localidades [66]. Todos los análisis estadísticos fueron hechos con el programa BioEstat 5.0 [67].
RESULTADOS
Riqueza ictiológica de las ocho lagunas estudiadas
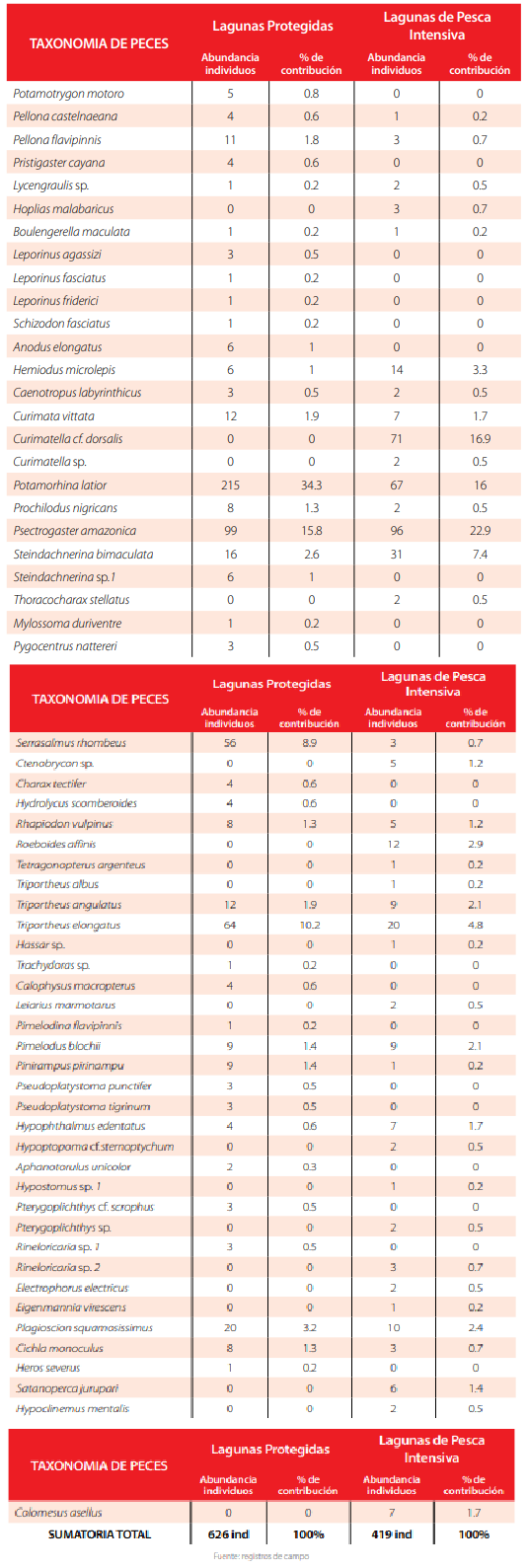
En el presente estudio se registraron 1045 peces pertenecientes a 60 especies, 21 familias y ocho órdenes en los ocho lagos estudiados (Tabla 2). Los órdenes Characiformes con ocho familias y Siluriformes con cuatro familias, fueron los más representativos del área de estudio, mientras que Clupeiformes, Gymnotiformes y Perciformes únicamente estuvieron representados por dos familias para cada orden y Rajiformes, Pleuronectiformes y Tetraodontiformes solamente registraron una sola familia.
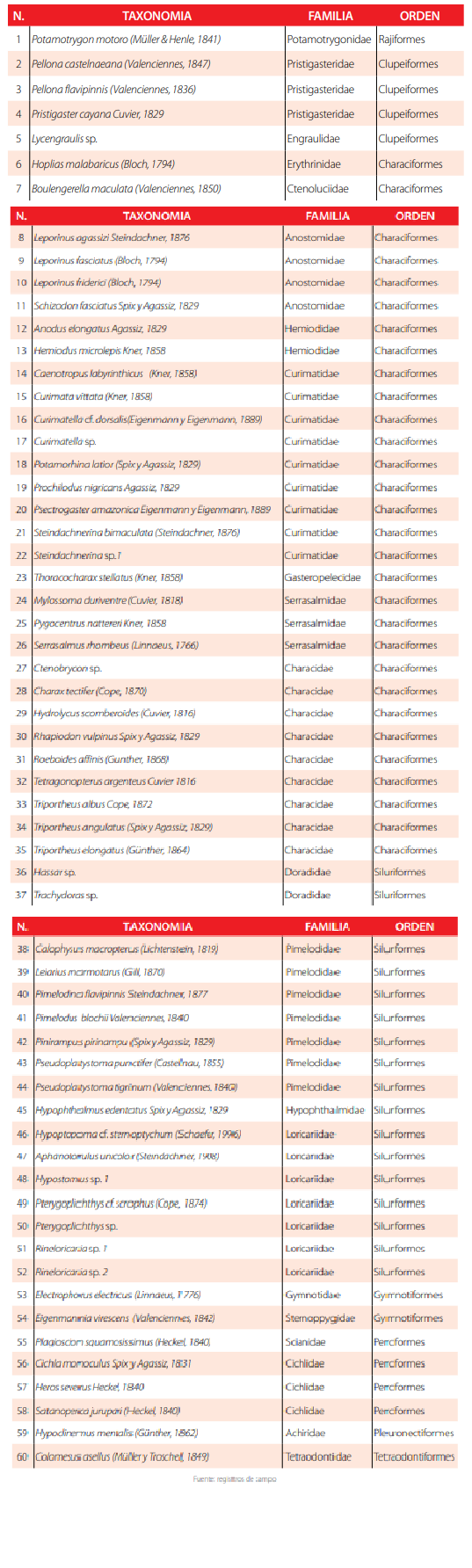
Nómina de especies de peces lacustres registrados en el área de estudio.
En las ocho lagunas estudiadas las familias ictiológicas con mayor número de especies fueron Curimatidae (9), Characidae (9), Pimelodidae (7) y Loricariidae (7) (Fig. 2). Todas las especies de peces capturados, con excepción de Colomesus asellus son utilizadas para alimento de las familias kichwa del área. Las especies de menor tamaño se usan como carnadas de pesca mientras que las especies más grandes (Pseudoplatystoma, Prochilodus, Potamorhina, Callophysus, Pinirampus, Leiarius, Pimelodina y Potamotrygon) pueden ser objeto de comercio local.
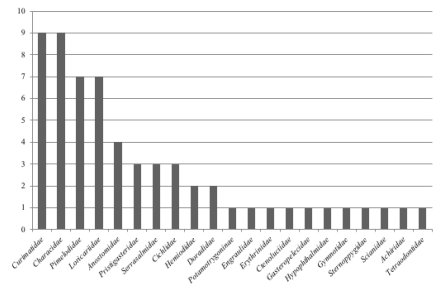
Número de especies por familias de peces lacustres.
Curvas de acumulación de especies y estimadores de riqueza ictiológica
De acuerdo al estimador Chao 1, se calculó la existencia potencial de al menos 66.6 especies de peces en las ocho lagunas, de las cuáles en nuestro muestreo se registraron 60 especies (Sobs), alcanzando un 90.09% de la riqueza potencial de peces en el área de estudio. La curva de acumulación de especies no alcanzó aún su asintonía sugiriendo la existencia de nuevas especies que durante el presente estudio aún no fueron registradas (Fig. 3).
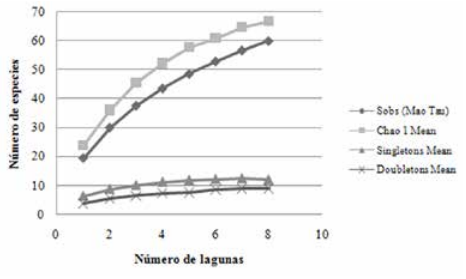
Curva de acumulación de especies para las 8 lagunas en estudio
De acuerdo al estimador Chao 1, se calculó la existencia potencial de al menos 41.55 especies de peces en las cuatro lagunas bajo pesca intensiva, de las cuáles en el presente muestreo se registraron 39 especies (Sobs), alcanzando un 93.86% de la riqueza potencial de peces (Fig. 4). Así mismo, se calculó la existencia potencial de al menos 59 especies de peces en las cuatro lagunas protegidas, de las cuáles en el presente muestreo se registraron 41 especies (Sobs), alcanzando un 69.49% de la riqueza potencial de peces existente (Fig. 5).
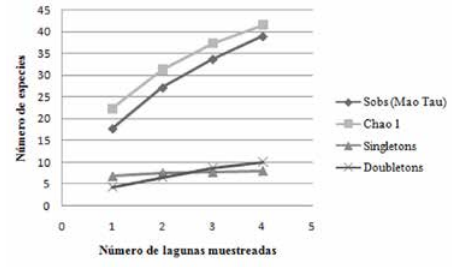
Curva de acumulación de especies para las lagunas bajo pesca intensiva
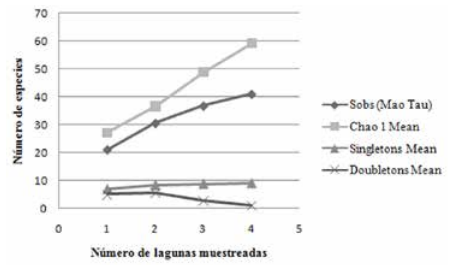
Curva de acumulación de especies para las lagunas protegidas
Curvas de diversidad-dominancia para contraste de la estructura y composición de las comunidades bajo estudio
Las curvas de las lagunas bajo pesca intensiva y lagunas protegidas registraron una forma análoga entre sí, lo cual indica una dominancia numérica similar de las especies en ambas comunidades. Se observa también un patrón similar en la distribución de las abundancias de las especies dominantes y raras. El ancho similar de las curvas sobre el eje x es un indicador de riqueza similar de especies entre las dos comunidades de peces analizadas. El tamaño similar de la cola de la curva en ambos tipos de lagunas también refleja un número bastante parejo de las especies raras (Figs. 6-7).
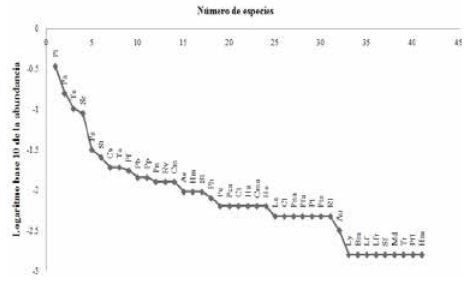
Curva de rango abundancia de peces de lagunas protegidas.
Siglas: Pl Potamorhina latior, Pa Psectrogaster amazonica, Te Triportheus elongatus, Sr Serrasalmus rhombeus, Ps Plagioscion squamosissimus, St Steindachnerina bimaculata, Cv Curimata vittata, Ta Triportheus angulatus, Pf Pellona flavipinnis, Pb Pimelodusblochii, Pp Pinirampus pirinampu, Pn Prochilodus nigricans, Rv Rhapiodon vulpinus, Cm Cichla monoculus, Ae Anodus elongatus,Hm Hemiodus microlepis, S1 Steindachnerina sp.1, Ph Potamotrygon motoro, Pc Pellona Castelnaeana, Pca Pristigaster cayana, CtCharax tectifer, Hs Hydrolycus scomberoides, Cma Calophysus macropterus, He Hypophthalmus edentatus, La Leporinus agassizi,Cl Caenotropus labyrinthicus , Pna Pygocentrus nattereri, Pfa Pseudoplatystoma punctifer, Pt Pseudoplatystoma tigrinum, PtsPterygoplichthys cf. scrophus, R1 Rineloricaria sp. 1, Au Aphanotorulus unicolor, Ly Lycengraulis sp., Bm Boulengerella maculata,Lf Leporinus fasciatus, Lfr Leporinus friderici, Sf Schizodon fasciatus, Md Mylossoma duriventre, Tr Trachydoras sp., Pfl Pimelodinaflavipinnis, Hse Heros severus
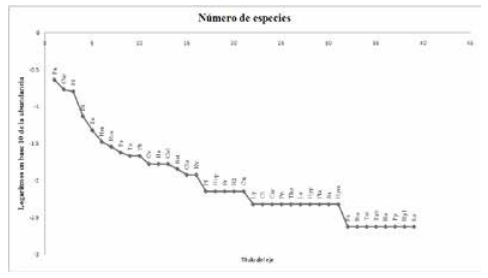
Curva de rango abundancia de peces de lagunas de pesca intensiva
Siglas: Pa Psectrogaster amazonica, Cur Curimatella cf. dorsalis, Pl Potamorhina latior, St Steindachnerina bimaculata, Te Triportheus elongatus, Hm Hemiodus microlepis, Roe Roeboides affinis, Ps Plagioscion squamosissimus, Ta Triportheus angulatus, Pb Pimelodus blochii, Cv Curimata vittata, He Hypophthalmus edentatus, Col Colomesus asellus, Sat Satanoperca jurupari, Cte Ctenobrycon sp.,Rv Rhapiodon vulpinus, Pf Pellona flavipinnis, Hop Hoplias malabaricus,Sr Serrasalmus rhombeus,R2 Rineloricaria sp. 2, Cm Cichlamonoculus, Ly Lycengraulis sp., Cl Caenotropus labyrinthicus, Cur Curimatella sp., Pn Prochilodus nigricans, Tho Thoracocharaxstellatus, Le Leiarius marmotarus, Hyp Hypostomus sp. 1, Pte Pterygoplichthys sp., Ee Electrophorus electricus, Hym Hypoclinemusmentalis, Pc Pellona castelnaeana, Bm Boulengerella maculata, Tet Tetragonopterus argenteus,Tab Triportheus albus, Hs Hassar sp.,Pp Pinirampus pirinampu, Hyl Hypoptopoma cf.sternoptychum, Ev Eigenmannia virescens.La secuencia en la abundancia de las especies en los dos tipos de lagunas registró diferencias notables. En las lagunas de pesca intensiva, las especies más comunes fueron Psectrogaster amazonica (22.9%), Curimatella cf. dorsalis (16.9 %), Potamorhina latior (16%), Steindachnerina bimaculata (7.4 %) y Triportheus elongatus (4.8 %), con una contribución del 68% del total de individuos capturados. En las lagunas protegidas, el orden de las especies más comunes y dominantes del ensamble inició con Potamorhina latior (34.3% del total), seguido de Psectrogaster amazonica (15.8%), Triprotheus elongatus (10.2%), Serrasalmus rhombeus (8.9%) y Plagioscion squamosissimus (3.2%) con un aporte del 72.4 % del total de individuos registrados (Tabla 3) (Figura 8).
Abundancia registrada de los peces de lagunas protegidas y de pesca intensiva del área de estudio.

Especies de peces más abundantes de las lagunas muestreadas.
La rareza de especies en ambas comunidades únicamente compartió una especie en común: Boulengerella maculata. Las especies raras de las lagunas bajo pesca intensiva fueron Eigenmannia virescens, Hassar sp., Hypostomus sp. 1, Pellona castelnaeana, Pinirampus pirinampu, Tetragonopterus argenteus y Triportheus albus. En las lagunas protegidas, las especies raras fueron Heros severus, Leporinus fasciatus, Leporinus friderici, Lycengraulis sp., Mylossoma duriventre, Pimelodina flavipinnis, Schizodon fasciatus y Trachydoras sp.
Diversidad beta: recambio de especies entre hábitats
La similitud en la composición de especies entre los dos tipos de lagunas, según el índice de Bray-Curtis fue de un 50% (IScuant= 0.509). El porcentaje de especies compartidas entre las lagunas pesca intensiva y las protegidas alcanzó un 33.33%. Existió además un 35% de especies exclusivas para las lagunas protegidas y un 31.66 % de especies de lagunas bajo pesca intensiva.
Las especies exclusivas de las lagunas bajo pesca intensiva fueron las siguientes: Hoplias malabaricus, Curimatella cf. dorsalis, Curimatella sp., Thoracocharax stellatus, Ctenobrycon sp., Roeboides affinis, Tetragonopterus argenteus, Triportheus albus, Hassar sp., Leiarius marmotarus, Hypoptopoma cf.sternoptychum, Hypostomus sp. 1, Pterygoplichthys sp., Rineloricaria sp. 2, Electrophorus electricus, Eigenmannia virescens, Satanoperca jurupari, Hypoclinemus mentalis y Colomesus asellus.
Las especies exclusivas de lagunas protegidas fueron las siguientes: Potamotrygon motoro, Pristigaster cayana, Leporinus agassizi, Leporinus fasciatus, Leporinus friderici, Schizodon fasciatus, Anodus elongatus, Steindachnerina sp.1, Caenotropus labyrinthicus, Mylossoma duriventre, Pygocentrus nattereri, Charax tectifer, Hydrolycus scomberoides, Trachydoras sp., Calophysus macropterus, Pimelodina flavipinnis, Pseudoplatystoma punctifer, Pseudoplatystoma tigrinum, Aphanotorulus unicolor, Pterygoplichthys cf. scrophus, Rineloricaria sp. 1 y Heros severus.
Patrones de Biomasa
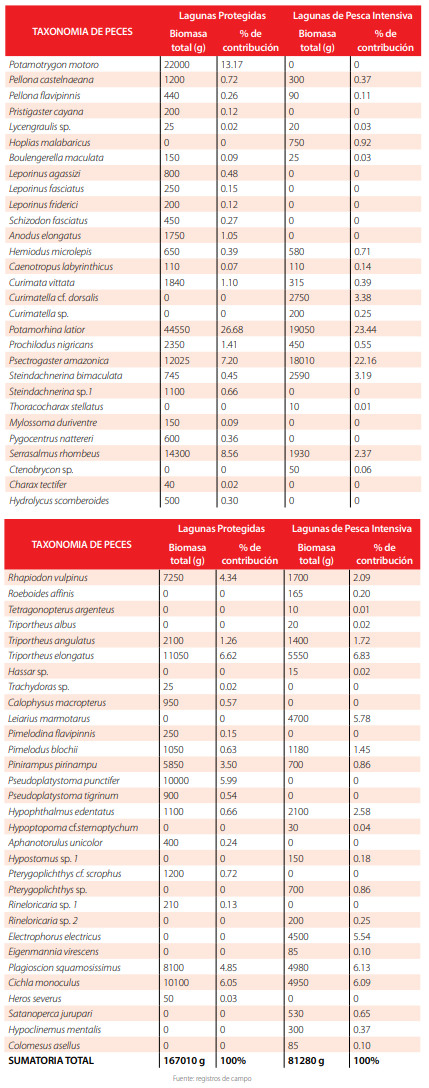
En cuanto a la biomasa, las especies que aportaron con mayor porcentaje en biomasa en lagunas de pesca intensiva fueron Potamorhina latior (23.44%), Psectrogaster amazonica (22.16%), Triportheus elongatus (6.83%), Plagioscion squamosissimus (6.13%) y Cichla monoculus (6.09%), contribuyendo con el 64.65 % de la biomasa total. En las lagunas protegidas, las cinco especies que aportan con mayor biomasa fueron: Potamorhina latior (26.68% del total), Potamotrygon motoro (13.17%), Serrasalmus rhombeus (8.56 %), Psectrogaster amazonica (7.20%) y Triportheus elongatus (6.62%) con un aporte del 62.23% de la biomasa total (Tabla 4).
Biomasa de los peces de lagunas protegidas y de pesca intensiva del área de estudio.
Incidencia de la pesca artesanal en la comunidad de peces lacustres
El análisis estadístico realizado indica que se puede rechazar la hipótesis nula de igualdad para la variable de talla media de los peces en mm entre los dos tipos de lagunas estudiadas (U=0.00, P= 0.0209). Los peces de las lagunas protegidas presentaron un promedio mayor en longitud estándar que los peces de las lagunas bajo pesca intensiva. Para las otras variables biológicas analizadas, la prueba U de Mann-Whitney indica que no es posible rechazar la hipótesis nula de igualdad en cuanto a riqueza de especies (U=7, P= 0.7728), abundancia (U=6, P= 0.5637), biomasa (U=2, P= 0.0833), CPUE en número de peces/ redes (U= 4, P= 0.248) y CPUE en kg. de peces/ redes (U= 3, P= 0.1489). Sin embargo, también se observó un valor cercano a la significación (valores cercanos a P= 0.05) para la biomasa/ 1 hora (Fig. 9).
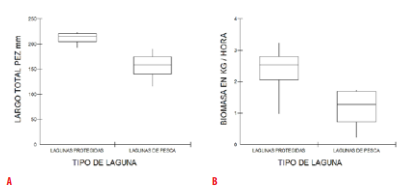
Resultados del análisis estadístico para las variables largo total del pez en mm (A) y biomasa en kg/ hora (B) entre las lagunas protegidas y las lagunas de pesca intensiva.
DISCUSIÓN
El número total de especies de peces registrados representó un 50% del número actual de especies registradas para la cuenca baja del río Curaray [37]. La riqueza total registrada en este estudio resultó ser menor a la encontrada en lagos ubicados a menos de 100 km. de distancia en la cuenca baja del río Yasuní (70 especies) [16] y en la cuenca baja delrío Pinduc (83 especies) [46]. Sin embargo, los cuerpos de agua en este estudio fueron objeto de mayor esfuerzo de muestreo. Según la curva asintónica de acumulación de especies, se espera un incremento de especies a medida que se desarrollen nuevos muestreos en el área en diferentes épocas del año.
El patrón de mayor dominancia de Characiformes y Siluriformes hallado coincide con el registrado para otros lugares de la Amazonia norte y central del Ecuador y del Perú [16, 37, 46, 68-70]. El número total de especies de peces registradas representó el 6.30% de la fauna ictiológica de agua dulce e intermareal reportada para Ecuador [71].
De las sesenta especies registradas únicamente cuatro (Curimata vittata, Charax tectifer, Roeboides affinis, Electrophorus electricus) constan como especies consideradas bajo Preocupación Menor (LC) por su mayor abundancia y amplia distribución [72]. Las demás especies aún no han sido evaluadas en la Lista de Especies Amenazadas a pesar de su importancia en la pesca artesanal, como tampoco cuentan con algún tipo de evaluación respecto de su situación actual de amenaza en el Ecuador.
En ambos tipos de lagunas analizadas, las cinco primeras especies más numerosas aportaron con aproximadamente un 70% del número total de individuos colectados.
Se observó una notable reducción de un 18.35% en número de individuos para Potamorhina latior y de un 5.45% para Triportheus elongatus en las lagunas bajo pesca intensiva. Así mismo, Psectrogaster amazonica incrementó en un 7.1% el número de individuos en este tipo de lagos. En lagos de Mamaré, en Bolivia, peces de los géneros Potamorhina y Triportheus también fueron las especies más abundantes de las comunidades ictiológicas copando más de un 50% de las capturas hechas [11].
Otro hallazgo de interés para las lagunas protegidas fue la presencia de dos piscívoros como Serrasalmus rhombeus y Plagioscion squamosissimus como especies dominantes de esta comunidad. Esto contrasta con las lagunas bajo pesca intensiva ya que no se observaron especies piscívoras dominantes.
Las curvas de diversidad-dominancia ilustraron cambios en ambas comunidades analizadas. Especies más dominantes de la comunidad de lagunas protegidas tales como Potamorhina latior, Triportheus elongatus, Plagioscion squamosissimus y Triportheus angulatus pasaron a ocupar posiciones de menor dominancia en las lagunas bajo pesca intensiva. Esta reducción en su abundancia posiblemente es producto de las actividades de pesca. Es importante resaltar que curimátidos como Potamorhina sustentan en gran parte a las pesquerías locales amazónicas y son capturados indiscriminadamente con redes en las lagunas durante las épocas de aguas bajas en la Amazonía [27], lo cual podría en el futuro afectar negativamente a las poblaciones de estos peces que están en la base de la cadena alimenticia lacustre.
En lagunas de pesca intensiva se observó también una tendencia hacia la reducción de la dominancia para cuatro especies piscívoras (de captura frecuente con líneas deanzuelos): Serrasalmus rhombeus, Plagioscion squamosissimus, Pinirampus pirinampu y Cichla monoculus. Así mismo, otras especies piscívoras de mayor rareza natural y tamaño corporal tales como Potamotrygon motoro, Calophysus macropterus, Pseudoplatystoma punctifer y Pseudoplatystoma tigrinum únicamente se encontraron en las lagunas protegidas. En las lagunas de pesca intensiva aparecieron Hoplias malabaricus, Electrophorus electricus y Leiarius marmoratus como especies piscívoras poco dominantes del ensamble, cuyo tamaño corporal registrado fue menor comparado con las especies piscívoras de las lagunas protegidas. Esta tendencia inicial hacia la reducción de especies de mayor tamaño encontrada concuerda con la preferencia generalizada de los pescadores de capturar y exterminar primero los stocks de especies piscívoras grandes para luego dedicarse a la captura de especies detritívoras y omnívoras de menor talla y valor comercial [28, 61,62]. Por ejemplo, especies del género Pseudoplatystoma tienen gran importancia en pesquerías amazónicas [8] y siempre son las más explotadas independientemente del tipo de aparejo usado.
Las curvas diversidad - dominancia reflejaron cambios para especies bentívoras situadas en la base de la cadena alimenticia de los lagos que son de captura frecuente con las redes de pesca. Potamorhina latior, Curimata vittata y principalmente Prochilodus nigricans redujeron su dominancia en las lagunas de pesca intensiva. Los bocachicos del género Prochilodus son catalogados como “ingenieros de ecosistemas” por su papel fundamental en la remoción de sedimentos orgánicos bénticos [73-75]. Desde este punto de vista, la pesca indiscriminada de Prochilodus o Potamorhina podría tener graves efectos negativos para estos ecosistemas lacustres a mediano plazo.
La piraña Serrasalmus rhombeus, un piscívoro lacustre, fue notablemente más abundante en las lagunas protegidas de acuerdo a las curvas de diversidad - dominancia. Estudios previos sugieren que las pirañas son especies que por su gran capacidad predatoria pueden generar cambios en los ensambles de peces [28]. En este contexto, la mayor abundancia de Serrasalmus rhombeus podría tener influencia directa en la distinta composición de especies encontrada entre los dos tipos de lagunas comparadas. Los pescadores kichwa del área de estudio mencionaron frecuentemente como una característica específica para las lagunas protegidas es la mayor abundancia de pirañas y rayas, al pescar con anzuelos. Estudios adicionales se requieren para confirmar la idea de considerar el nivel de abundancia de Serrasalmus rhombeus como un buen indicador del nivel de pesca lacustre artesanal.
En el presente estudio solamente se encontraron diferencias estadísticamente significativas en la talla de los peces como un efecto potencial de un incremento en el nivel de la pesca artesanal lacustre local. En las lagunas protegidas, el largo estándar promedio de los peces fue mayor debido a que se encontró individuos adultos de especies de peces de gran tamaño. Este hallazgo concuerda con lo planteado por Kantoussan et al. [12] al indicar que la abundancia decreciente de especies grandes en lagos de pesca intensiva, puede ser un signo de un cambio en la estructura de la comunidad por mayor presión de pesca. Así como, la ausencia de especies grandes es un buen índice que refleja un ecosistema explotado [12].
De acuerdo a la biomasa de captura, las cinco primeras especies aportaron con más de un 60% en biomasa a cada una de las dos comunidades. Potamorhina latior es la especie que más aportó en biomasa en ambos tipos de lagunas evaluadas con másde un 20%. En las lagunas protegidas, dos piscívoros como Potamotrygon hystrix y Serrasalmus rhombeus contribuyeron a la biomasa de la comunidad con un 13.1% y 8.5% respectivamente. En las lagunas bajo pesca intensiva en cambio fueron Plagioscion squamosissimus y Cichla monoculus quienes aportaron con un 6% a la biomasa total como especies piscívoras. Otro hallazgo notable es el aumento en el aporte en biomasa de Psectrogaster amazonica de un 7.2% en las lagunas protegidas a un 22.16% en las lagunas de pesca intensiva.
Además, se observó una diferencia cercana a la significación estadística en la biomasa de captura por hora entre los dos tipos de lagunas estudiadas, lo cual podría ser un síntoma inicial de una posible pérdida de ejemplares más grandes y pesados por efectos de una mayor pesca selectiva enfocada a las especies más valoradas comercialmente y la consecución de carnada para bagres. En Loreto (Perú), un estudio realizado confirmó que en sitios de mayor presión de pesca ornamental hubo una reducción significativa de la biomasa de peces riparios [63]. Es necesario continuar con la medición de la variable biomasa de captura a más largo plazo en las lagunas estudiadas para confirmar esta tendencia inicial encontrada.
En el área de estudio se observa un incremento sostenido de la pesca artesanal con propósitos comerciales. Los pescadores usan más frecuentemente las lagunas más cercanas a los poblados kichwa desde hace décadas por su mayor facilidad de acceso en canoa al espejo de agua. La pesca con redes en las lagunas, para captura de carnada comienza a afectar principalmente a las especies bentívoras más grandes (Prochilodus, Potamorhina). La pesca con líneas o “calandras” en cambio, afecta más a ciertos bagres grandes como Pseudoplatystoma, Pinirampus y a pirañas del género Serrasalmus. Esta presión selectiva por las distintas especies de peces que los pescadores hacen en lo cotidiano se refleja en las diferencias encontradas en el presente estudio.
El hallazgo de tallas menores en los peces de las lagunas bajo pesca intensiva sugieren la necesidad de plantear y aplicar medidas tendientes a regular el uso de dos aparejos de pesca lacustre de mayor impacto: las redes de agallas y las líneas o calandras. Debe discutirse con los pescadores kichwa la forma de regulación más adecuada: por duración de uso del aparejo, por el tipo de aparejo, por el tamaño de las redes y los anzuelos empleados o la veda temporal o total de ciertas lagunas de pesca intensiva para asegurar la conservación de los peces locales. Los resultados iniciales aquí encontrados también sugieren la necesidad de hacer réplicas anuales en lo posterior para confirmar las tendencias encontradas inicialmente.
AGRADECIMIENTOS
Agradecemos a Rosa Vacacela, directora del Instituto Quichua de Biotecnología Sacha Supai (IQBSS) por el respaldo institucional y financiamiento para el desarrollo de este trabajo realizado en el marco de ejecución del proyecto Fortalecimiento del Sumak Kawsay, el control y la gestión territorial y del gobierno de las Circunscripciones Territoriales del Pueblo Kichwa de Pastaza, con equidad de género PRO-2010k 1/0054, ejecutado por el IQBSS en convenio con la Fundación Paz y Solidaridad de Euskadi.
Este trabajo se realizó con autorización de investigación científica N. 08-IC-FAU-DPPZ/ MA emitida por la Dirección Provincial de Pastaza, del Ministerio del Ambiente. Los especímenes colectados reposan en la colección ictiológica del Museo Ecuatoriano de Ciencias Naturales (MECN), de Quito.
CONTRIBUCIÓN DE LOS AUTORES
Iván Jácome-Negrete concibió la investigación, diseñó la metodología y dirigió su aplicación en campo, realizó el análisis e interpretación de los datos y redactó el manuscrito; Segundo Santi, Aurelio Cuji, Eduardo Viteri, Valencio Alvarado, Pastor Inmunda, Roque Dahua, Jorge Tapuy y Toribio Tapuy desarrollaron la metodología y realizaron el trabajo de campo.
REFERENCIAS
[1] Arthington, A., Lorenzen, K., Pusey, B., Abell, R., Halls, A., Winemiller, K., Arrington, D. & Baran, E. (2004). River fisheries: ecological basis for management and conservation. En R. Welcomme & T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume I. (pp. 21-60). Bangkok: FAO Regional Office for Asia and the Pacific.
[2] Junk, W. & Wantzen, K. (2004). The flood pulse concept: new aspect, approaches and applications – an update. En R. Welcomme & T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume II. (pp. 117-140). Bangkok: FAO Regional Office for Asia and the Pacific.
[3] Rahim, K., Daud, S., Siraj, S., Arshad, A., Esa, Y. & Ibrahim, E. (2009). Freshwater Fish Diversity and Composition in Batang Kerang Floodplain, Balai Ringin, Sarawak. Pertanika Journal Tropical Agricultural Science, 32, (1),7-16.
[4] Junk, W. (1983). Aquatic Habitats in Amazonia.The Enviromentalist, 3(5), 24-34.
[5] Harvey, B. & Carolsfeld, J. (2003). Fishes of the Floods. En J. Carolsfeeld, B. Harvey, C. Ross & A, Baer (Eds.), Migratory Fishes of South America. (pp. 5-18). Canadá: World Fisheries Trust, The World Bank, International Development Research Centre.
[6] Larinier, M. & Marmulla, G. (2004). Fish passes: types, principles and geographical distribution an overview. En R. Welcomme & T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume II. (pp. 117-140). Bangkok: FAO Regional Office for Asia and the Pacific.
[7] Chen, D., Duan, X., Liu, S. & Shi, W. (2004). Status and management of fisheries resources of the Yangtze River. En R. Welcomme & T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume I. (pp. 173-182). Bangkok: FAO Regional Office for Asia and the Pacific.
[8] Araujo-Lima, C. & Ruffino, M. (2003). Migratory fishes of the Brazilian Amazon. En J. Carolsfeeld, B. Harvey, C. Ross & A, Baer (Eds.), Migratory Fishes of South America. (pp. 233-301). Canadá: World Fisheries Trust, The World Bank, International Development Research Centre.
[9] Zalinge, N., Degen, P., Pongsri, C., Nuov, S., Jensen, J., Nguyen, V. & Choulamany, X. (2004). The Mekong River System. En R. Welcomme &T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume I. (pp. 335-357). Bangkok: FAO Regional Office for Asia and the Pacific.
[10] Toivonen, T., Mäki, S. & Kalliola, R. (2007). The riverscape of Western Amazonia – a quantitative approach to the fluvial biogeography of the region. Journal of Biogeography, 34, 1374-1387. http://dx.doi.org/10.1111/j.1365-2699.2007.01741.x
[11] Pouilly, M. & Rodríguez, M. (2004). Determinism of fish assemblage structure in Neotropical structure lakes: influence of internal and landscape lake conditions. En R. Welcomme & T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume II. (pp. 243-265). Bangkok: FAO Regional Office for Asia and the Pacific.
[12] Kantoussan, J., Ecoutin, J., Simier, M., Fontenelle, G., Thiaw, O. & Läe, R. (2007). The relevance of species-based indicators as tool for evaluating the structure of exploited fish assemblages: a comparative study of two tropical lakes in Mali, West Africa. Lakes & Reservoirs: Research and Management, 12, 135-148. http://dx.doi.org/ 10.1111/j.1440-1770.2007.00330.x
[13] Riofrío, J., Ferré, W. &Velarde, D. (2008). Contribuciones para el manejo de la pesquería comercial en Pucallpa (Ucayali, Perú). En D. Pinedo & C. Soria (Eds.), El Manejo de las Pesquerías en Ríos Tropicales de Sudamérica. (pp. 237-256). Colombia: Mayol Ediciones S.A.
[14] Andrew, N., Béne, C., Hall, S., Allison, E., Heck, S. & Ratner, B. (2007). Diagnosis and management of small-scale fisheries in developing countries. Fish and Fisheries, 8, 227-240
[15] Silva, A. & Begossi, A. (2004). Uso de recursos por ribeirinhos no médio rio Negro. En A. Begossi (Ed.), Ecologia de Pescadores da Mata Atlântica e da Amazônia (pp. 89-148). São Paulo:Editora Hucitec, NEPAM/UNICAMP, NUPAUB/ USP/FAPEST.
[16] Galacatos, K., Barriga-Salazar, R. & Stewart, D. (2004). Seasonal and hábitat influences on fish communities within the lower Yasuni River basin of the Ecuadorian Amazon. Enviromental Biology of Fishes, 71, 33-51.
[17] Welcomme, R. & Halls, A. (2004). Dependence of tropical river fisheries on flow. En R. Welcomme & T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume II. (pp. 267- 283). Bangkok: FAO Regional Office for Asia and the Pacific.
[18] Lorenzen, K., Garaway, C., Chamsingh, B. & Warren, T. (1998). Effects of access restrictions and stocking on small water body fisheries in Laos. Journal of Fish Biology,53, A, 345-357.
[19] Bené. C. & Neiland A. (2004).Contribution of inland fisheries to rural livelihoods in Africa: an overview from the lake Chad Basin Areas. En R. Welcomme & T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume II. (pp. 67-77). Bangkok: FAO Regional Office for Asia and the Pacific.
[20] Payne, A., Sinha, R., Singh, H. & Huq, S. (2004). A review of the Ganges Basin: its fish and fisheries. En R. Welcomme & T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume I. (pp. 229-251). Bangkok: FAO Regional Office for Asia and the Pacific.
[21] McGrath, D., Silva, U. & Crossa, N., (1998). A traditional floodplain fishery of the lower Amazon River, Brasil, The World Fish Center. http://EconPapers.repec.org/RePEc:wfi:wfbook:33696.
[22] Castro, E., Borios, S. & Summers, P. (2008). La pesca en la cuenca amazónica del río Pachitea, Perú. En D. Pinedo & C. Soria (Eds.), El Manejo de las Pesquerías en Ríos Tropicales de Sudamérica. (pp. 39-74). Colombia: Mayol Ediciones S.A.
[23] Paz, S. & Damme, P. (2008). Caracterización de las pesquerías en la Amazonía boliviana. En D. Pinedo & C. Soria (Eds.), El Manejo de las Pesquerías en Ríos Tropicales de Sudamérica. (pp. 205-233). Colombia: Mayol Ediciones S.A.
[24] Silva, A. & Begossi, A. (2009). Biodiversity, food consumption and ecological niche dimension: a study case of the riverine populations from the Rio Negro, Amazonia, Brasil. Environment Development Sustainability 11, 489-507. http://dx.doi.org/10.1007/s10668-007-9126-z
[25] Noriega, J. (2008). Pesca y participación comunal en la Reserva Nacional Pacaya Samiria, Loreto, Perú. En D. Pinedo & C. Soria (Eds.), El Manejo de lasPesquerías en Ríos Tropicales de Sudamérica. (pp. 381- 407). Colombia: Mayol Ediciones S.A.
[26] Diaz-Sarmiento, J. & Alvarez-León, R. (2003). Migratory Fishes of the Colombian Amazon. En J. Carolsfeeld, B. Harvey, C. Ross & A, Baer (Eds.), Migratory Fishes of South America. (pp. 302-344). Canadá: World Fisheries Trust,The World Bank, International Development Research Centre.
[27] Duque, S., Prieto-Piraquive, E., Bolívar, A., Dámaso, J., Ipuchima, A., Corrales, B., Carrizosa, E., Granado-Lorencio, C. & Rodríguez, C. (2008). Manejo sostenible de las pesquerías de los lagos de Yahuarcaca (Amazonía colombiana): una mirada desde el conocimiento local. En D. Pinedo & C. Soria (Eds.), El Manejo de las Pesquerías en Ríos Tropicales de Sudamérica. (pp. 271- 281). Colombia: Mayol Ediciones S.A.
[28] Winemiller, K. (2004). Floodplain river food webs: generalizations and implications for fisheries management. En R. Welcomme & T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume II. (pp. 285-309). Bangkok: FAO Regional Office for Asia and the Pacific.
[29] Bayley, P. (2008). Sostenibilidad de la pesquería tropical continental: el dilema del administrador y una propuesta de solución. En D. Pinedo & C. Soria (Eds.), El Manejo de las Pesquerías en Ríos Tropicales de Sudamérica. (pp. 257- 269). Colombia: Mayol Ediciones S.A.
[30] Ruffino, M. (2008). Gestión compartida de recursos pesqueros en la Amazonía. En D. Pinedo & C. Soria (Eds.), El Manejo de las Pesquerías en Ríos Tropicales de Sudamérica. (pp. 307- 320). Colombia: Mayol Ediciones S.A.
[31] Berkes, F. (2008). La pesquería de pequeña escala: alternativas al manejo convencional de recursos. En D. Pinedo & C. Soria (Eds.), El Manejo de las Pesquerías en Ríos Tropicales de Sudamérica. (pp. 443- 459). Colombia: Mayol Ediciones S.A.
[32] Almeida, O., McGrath, D., Rivero, S. & Lorenzen, K. (2008). Impacto del comanejo pesquero sobre la pesca en la Amazonía brasileña: caracterización, análisis multiagentes e interacciones. En D. Pinedo & C. Soria (Eds.), El Manejo de las Pesquerías en Ríos Tropicales de Sudamérica. (pp. 321- 332). Colombia: Mayol Ediciones S.A.
[33] Silvano, R., Ramires, M. & Zuanon, J. (2009). Effects of fisheries management on fish communities in the floodplain lakes of a Brazilian Amazonian Reserve. Ecology of Freshwater Fish, 18, 156-166. http://dx.doi.org/ 10.1111/j.1600-0633.2008.00333.x
[34] Begossi, A., Castro, F. & Silvano, R. (2004). Ecología Humana e Conservação. En A. Begossi (Ed.), Ecologia de Pescadores da Mata Atlântica e da Amazônia (pp. 313-324). São Paulo:Editora Hucitec, NEPAM/UNICAMP.
[35] Silvano, R. (2004). Pesca Artesanal e Etnoictiologia. En A. Begossi (Ed.), Ecologia de Pescadores da Mata Atlântica e da Amazônia (pp. 187-222). São Paulo:Editora Hucitec, NEPAM/UNICAMP, NUPAUB/USP/FAPEST.
[36] Reeve, M. (2002). Los Quichuas del Curaray – el proceso de la identidad. Quito: Ediciones Abya Yala.
[37] Jácome, I. (2005). Sumac Yacu – Introducción al conocimiento de los ecosistemas acuáticos y su diversidad, ecología, aprovechamiento y conservación de los peces de los territorios quichuas de Yana Yacu, Nina Amarun y Lorocachi, Pastaza. Quito: Ediciones Abya Yala.
[38] Vacacela, R. (2007). Sumac Causai –Vida en armonía. Quito: Impresiones Abya Yala.
[39] Albuja L, Almendáriz A, Barriga R, Montalvo L, Cáceres F & Román J. (2012). Fauna de Vertebrados del Ecuador. Quito: Arial 12 editorial. http://bibdigital.epn.edu.ec/handle/15000/5612
[40] Sierra, R. (Ed.). (1999). Propuesta Preliminar de un sistema de Clasificación de Vegetación para el Ecuador Continental. Quito: Proyecto INEFAN/GEF - BIRF y Ecociencia.
[41] Cañadas, L. (1983). El Mapa Bioclimático y Ecológico del Ecuador. Quito: MAG-PRONAREG.
[42] Stewart, D., Barriga, R & Ibarra, M. (1987). Ictiofauna de la cuenca del río Napo, Ecuador Continental: lista anotada de especies. Revista de Información Técnico-Científica Politécnica, 12, 4, Biología 1(9)-42.
[43] Castro, D. (1994). Peces del Río Putumayo Sector del Puerto Leguízamo. Mocoa: Corporación Autónoma Regional del Putumayo. Servigráficas Ltda.
[44] Salinas,Y. y Agudelo, E. (2000). Peces de Importancia Económica en la Cuenca Amazónica Colombiana. Santafé de Bogotá: Instituto Amazónico de Investigaciones Científicas SINCHI-Ministerio del Medio Ambiente, Editorial Scripto Ltda.
[45] Buckup, P. (2003). Introdução ã sistemática de peixes neotropicais Volume II Chaves de Identifição (Rev. 2). Río de Janeiro: Departamento de Vertebrados, Museu Nacional, Universidade Federal do Rio de Janeiro.
[46] Jácome, I. & Guarderas, L. (2005). Sumac Jita – Introducción al conocimiento de la diversidad, ecología y uso de los principales recursos biológicos de tres ecosistemas de lagunas del Territorio quichua de Yana Yacu, Pastaza. Quito: Ediciones Abya Yala.
[47] Galvis, G., Mojica, J.I., Duque, S. R., Castellanos, C., Sánchez-Duarte, P., Arce, M., Gutiérrez, A., Jiménez, L.F., Santos, M., Vejarano-Rivadeneira, S., Arbeláez, F., Prieto, E. & Leiva, M. (2006). Peces del medio Amazonas. Región de Leticia. Serie de Guías Tropicales de Campo No. 5. Bogotá: Conservación Internacional, Editorial Panamericana.
[48] García, V. & Calderón, H. (2006). Peces de Pando, Bolivia - Especies de importancia comercial en mercados de la ciudad de Cobija. Universidad Amazónica de Pando Cobija – Bolivia, CIPA, The Field Museum, Gordon and Betty Moore Foundation, Chicago, USA.
[49] Osorio, D. & Ortega, H. (2006). Peces de Cocha Cashu – Estación Biológica Cocha Cashu, Parque Nacional MANU, Madre de Dios, Perú. Web Version.Rapid Color Guide No. 205 Versión 1.
[50] Rivadeneira, J.F., Anderson, E. & Dávila, S. (2010). Peces de la cuenca del río Pastaza, Ecuador. Quito: Fundación Natura.
[51] Hidalgo, M. (2011). Peces de las cuencas de los ríos Santiago y Morona. Rapid Color Guide No. 336 versión 1.
[52] Moreno, C.E. (2001). Métodos para medir la biodiversidad. Zaragoza: M&T-Manuales y Tesis SEA, vol. 1.
[53] Magurran, A.E. (2004). Measuring Biological Diversity. Oxford: Blackwell Science.
[54] Villarreal, H., Álvarez, M., Córdova, S., Escobar, F., Fagua, G., Gast, F., Mendoza, H., Ospina, M. & Umaña, A. (2006). Manual de métodos para el desarrollo de inventarios de biodiversidad. Bogotá: Programa de Inventarios de Biodiversidad. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Segunda edición.
[55] Colwell, R. (2009). EstimateS Statistical Estimation of Species Richness and Shared Species from Samples: an Online Reference. Versión 8.2.0. University of Connecticut, USA. Disponible en: http://viceroy.eeb.uconn.edu
[56] Correa, S. (2005). Comparison of fish assemblages in flooded forest versus floating meadows habitats of an upper amazon floodplain (Pacaya Samiria National Reserve, Peru).(MsC Thesis). University of Florida.
[57] Miranda-Chumacero, G. & Barrera, S. (2005). Riqueza y abundancia en dos lagunas de los Andes tropicales. Ecología en Bolivia 40 (2), 41-52.
[58] Carvajal-Cogollo, J. & Urbina-Cardona, J. (2008). Patrones de diversidad y composición de reptiles en fragmentos de bosque seco tropical en Córdova, Colombia. Tropical Conservation Science 1 (4), 397-416.
[59] Medina-Rangel, G. (2011). Diversidad alfa y beta de la comunidade de reptiles en el complejo cenagoso de Zapatosa, Colombia. Revista de Biología Tropical, 59(2), 935-968.
[60] Feinsinger, P. (2003). El Diseño de Estudios de Campo para la Conservación de la Biodiversidad. Santa Cruz de la Sierra: Editorial FAN.
[61] Cowx, I., Almeida, O., Bené, C., Brummett, R., Bush, S., Darwall,W., Pittock, J. & Brakel, M. (2004). En R. Welcomme &T. Petr (Eds.), Proceedings of the Second International Symposium on the Management of Large River for Fisheries Volume I. (pp. 1-20). Bangkok: FAO Regional Office for Asia and the Pacific.
[62] Yemane, D., Field, J. & Leslie, R. (2005). Exploring the effects of fishing on fish assemblages using Abundance Biomass Comparison (ABC) curves. International Council for the Exploration of the Sea Journal of Marine Science 62, 645-650.
[63] Gerstner, C., Ortega, H., Sanchez, H. & Graham, D. (2006). Effects of the freshwater aquarium trade on wild fish populations in differentially-fished areas of the Peruvian Amazon. Journal of Fish Biology 68, 862-875.
[64] Pinedo, D. (2008). La orfandad de los peces: uso consuetudinario de los recursos pesqueros en la cuenca del río Pichis, Perú. En D. Pinedo & C. Soria (Eds.), El Manejo de las Pesquerías en Ríos Tropicales de Sudamérica. (pp. 1- 17). Colombia: Mayol Ediciones S.A.
[65] Pinedo, D. y Soria, C. (2008). Las pesquerías como bienes comunes. En D. Pinedo & C. Soria (Eds.), El Manejo de las Pesquerías en Ríos Tropicales de Sudamérica. (pp. 1- 17). Colombia: Mayol Ediciones S.A.
[66] Sazima, S. (2007). As species de peixes oriundas da pesca artesanal num trecho do Baxio Rio Tieté: composicao,rendimiento e avaliacao empírica da sustentabilidade da pesca. (Dissertacao Mestrado). Universidade Estadual Paulista.
[67] Ayres, M., Ayres Jr., M., Lima, D. & Santos, A. (2007). BioEstat Aplicações Estatisticas nas Áreas Dás Ciencias Bio-Médicas. Belém, Pará, Brasil.
[68] Willink, P.W., Chernoff, B., Ortega, H., Barriga, R., Machado-Allison, A., Sánchez, H. & Salcedo, N. (2005). Fishes of the Pastaza River Watershed: Assessing the Richness, Distribution and Potential Threats. A Rapid Assessment of the Aquatic Ecosystems of the Pastaza River Basin, Ecuador and Perú. RAP Bulletin of Biological Assessment 33 (ed. Por P.W. Willink, B. Chernoff y J. McCullough) Washington, D.C: Conservation International.
[69] Alverson, W.S., Vriesendorp, C., del Campo, A., Moskovits, D.K., Stotz, D.F., García, M. & Borbor, L. (2008). Ecuador-Perú: Cuyabeno-Güeppí. Rapid Biological and Social Inventories Report 20. Chicago: The Field Museum.
[70] Ortega, H., Chocano, L., Palma, C. & Samanez, I. (2010). Biota acuática en la Amazonía Peruana: diversidad y usos como indicadores ambientales en el Bajo Urubamba (Cusco-Ucayali). Revista Peruana de Biología 17(1), 29-35. http://dx.doi. org/10.15381/rpb.v17i1.47
[71] Barriga, R. (2012). Peces de Agua Dulce. Revista Politécnica 30(3), 83-119.
[72] IUCN. (2016, julio). IUCN Red List of Threatened Species: an Online Reference. Version 2016.1. www.iucnredlist.org
[73] Flecker, A. (1996). Ecosystem engineering by a dominant detritivore in a diverse tropical stream. Ecology, 77 (6), 1845- 1854. http://dx.doi.org/ 10.2307/2265788.
[74] Castro, R. & Vari, P. (2004). Detritivores of South American Fish Family Prochilodontidae (Teleostei: Ostariophysi: Characiformes): A Phylogenetic and Revisionary Study. Sminthsonian Contributions to Zoology, 622, 1-187.
[75] Hall, R., Taylor, B. & Flecker, A. (2011). Detritivorous fish indirectly reduce insect secondary production in a tropical river. Ecosphere 2(12), 1-13. http://dx.doi.org/10.1890/ES11-00042.1