Ciencias de la vida
Identificación de parásitos gastrointestinales en aves acuáticas de la laguna Yahuarcocha, Imbabura, Ecuador: Parásitos gastrointestinales en aves acuáticas
Identification of gastrointestinal parasites in waterfowl at Yahuarcocha lagoon, Imbabura, Ecuador
Identificación de parásitos gastrointestinales en aves acuáticas de la laguna Yahuarcocha, Imbabura, Ecuador: Parásitos gastrointestinales en aves acuáticas
Avances en Ciencias e Ingenierías, vol. 16, núm. 2, e3291, 2024
Universidad San Francisco de Quito

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
Recepción: 23 Abril 2024
Aprobación: 20 Junio 2024
Resumen: La parasitosis en aves silvestres constituye una línea de estudio de vital importancia dentro de la ecología y de la salud animal. Este tipo de infecciones, causadas por una variedad de parásitos, pueden afectar significativamente la salud, el comportamiento y la dinámica de las poblaciones de aves. La interacción entre parásitos y sus hospedadores aviares es compleja y puede estar modulada por factores ambientales, genéticos y comportamentales. Comprender estos procesos es esencial para el manejo de la fauna silvestre y la preservación de la biodiversidad, así como para la prevención de enfermedades zoonóticas que pueden afectar a los humanos. Las infecciones parasitarias en aves silvestres son de amplia distribución y su ocurrencia es a nivel mundial; la mayor cantidad de casos presentados en estas son de carácter subclínico debido a las bajas concentraciones parasitarias. Se analizaron un total de 48 muestras de cinco especies de aves acuáticas de la laguna Yahuarcocha, se determinó la prevalencia, intensidad de infestación y coinfección de huevos y ooquistes de parásitos contenidas en las heces de las aves. Se utilizaron dos técnicas de diagnóstico: método coproparasitoscópico directo (método cualitativo) y la técnica de McMaster con solución de Sheater (método cuantitativo). Se identificaron cuatro géneros de parásitos en 23 aves: Ascaridia galli,Heterakis gallinarum,Capillaria sp., y Eimeria spp. Se estimó una prevalencia del 48 % (23/48), las cuales presentaron al menos uno de los géneros o especies identificadas. La prevalencia por hospedador fue del 60 % (3/5) en la Gallineta común; 50 % (9/18) en la Focha andina; 47% (8/17) en el Cormorán neotropical; 40 % (2/5) en el Pato rojizo andino; y 33% (1/3) en la Garza bueyera. Con respecto a la intensidad de infestación, las aves presentaron valores promedio de 271 (±74) huevos por gramo de heces (HPG) de A. galli;275(±98) HPG de H. gallinarum; 125 (±25) HPG de Capillaria sp. y de 236 (±139) ooquistes por gramo (OPG) de Eimeria spp. Se determinó el 30.43 % (7/23) de infecciones mixtas con mayor frecuencia de: H. gallinarum y Eimeria spp. en dos hospedadores.
Palabras clave: abundancia de parásitos, aves acuáticas silvestres, infecciones mixtas, parásitos.
Abstract: Parasitism in wild birds is an area of study of vital importance within ecology and animal health. These infections, caused by a variety of parasites, can significantly impact the health, behavior, and dynamics of bird populations. The interaction between parasites and their avian hosts is complex and can be influenced by environmental, genetic, and behavioral factors. Understanding these processes is crucial for wildlife management, biodiversity preservation, and the prevention of zoonotic diseases that can affect humans. Parasitic infections in wild birds are widely distributed globally, with many cases being subclinical due to low parasite concentrations. A total of 48 samples from five species of waterfowl from Yahuarcocha lagoon were analyzed to determine prevalence, infestation intensity, and co-infection of parasite eggs and oocysts in bird feces. Two diagnostic techniques were used: direct coproparasitoscopic method (qualitative) and McMaster technique with Sheater’s solution (quantitative). Four genera of parasites were identified in 23 birds: Ascaridia galli, Heterakis gallinarum, Capillaria sp., and Eimeria spp. The prevalence was estimated at 48 % (23/48), with at least one of the identified genera or species. Host-specific prevalence was 60 % (3/5) in the Common Gallinule; 50 % (9/18) in the Andean Coot; 47 % (8/17) in the Neotropical Cormorant; 40 % (2/5) in the AndeanRuddy Duck; and 33 % (1/3) in the Cattle Egret. Regarding infestation intensity, birds showed average values of 271 (±74) eggs per gram (EPG) of A. galli; 275 (±98) EPG of H. gallinarum; 125 (±25) EPG of Capillaria sp., and 236 (±139) oocysts per gram (OPG) of Eimeria spp. Mixed infections were found in 30.43 % (7/23) of cases, most commonly involving H. gallinarum and Eimeria spp. in two hosts.
Keywords: parasite abundance, aquatic wild birds, mixed infections, parasites.
INTRODUCCIÓN
La parasitosis en aves silvestres constituye un área de estudio de vital importancia dentro de la ecología y de la salud animal. Esta puede ser producida por diferentes agentes parasitarios tales como: nematodos, cestodos, trematodos y distintos tipos de protozoarios que pueden afectar la salud, el comportamiento y la dinámica de las poblaciones de aves. Los parásitos, que van desde protozoos microscópicos hasta gusanos macroscópicos, pueden influir en la supervivencia y en el éxito reproductivo de las aves [1]. Las aves acuáticas silvestres son organismos propensos a infestarse de manera natural por una gran diversidad de parásitos gastrointestinales que las afectan [1,2]. Estos organismos pueden ser adquiridos de forma directa por el consumo de alimento contaminado con formas infestantes [3], por contacto continuo con los elementos del medio, o indirectamente a través de hospedadores intermediarios [4]. El grado de parasitismo suele depender de factores biológicos como edad, sexo, condición fisiológica (madurez) del individuo y de los factores asociados al hábitat [5]. Actualmente se ha determinado que ciertas aves migratorias, con hábitos gregarios, son portadoras y posibles diseminadoras de una gran diversidad de patógenos como parásitos, virus y bacterias; un ejemplo claro de esto es la presencia en el Pato Triguero (Anas platyrhynchos diazi), del altiplano zacatecano de México, de Echinostomum revolutum, Capillaria sp. y Polymorphus ondatrae [6,7].
Estudios previos han evidenciado interacciones parasitarias de las aves costeras en diferentes niveles de la cadena trófica que incluyen peces [8] y crustáceos decápodos [9] que son hospedadores de una diversidad de helmintos (ej. digeneos, nemátodos y céstodos). Estos organismos, a su vez, constituyen el alimento principal de las aves como en el caso del Piquero de Patas Azules (Sula nebouxii) y otras aves de la familia Ardeidae [10]. A nivel regional existen importantes estudios sobre las diferentes parasitosis en aves silvestres acuáticas y terrestres que incluyen varios géneros [11,12,13] y especies en particular [14,15,16].
En contraste, en el Ecuador existen pocas aproximaciones al estudio de los endoparásitos de las aves de los hábitats acuáticos continentales, no obstante, importantes resultados han sido publicados sobre especies de ambientes particulares como las islas Galápagos [17,18] y ambientes urbanos [19]. En la laguna Yahuarcocha se han realizado estudios orientados a determinar: las tendencias temporales en las poblaciones aviares silvestres [20,21], los indicadores limnológicos, los niveles de eutrofización [22,23,24,25] y los efectos de ésta sobre los peces [26]. Sin embargo, se observa un vacío en el estudio de otros agentes como los microorganismos asociados a la fauna silvestre. En este contexto, el objetivo principal del estudio fue determinar y caracterizar los parásitos gastrointestinales de las aves comunes de laguna Yahuarcocha.
MATERIALES Y MÉTODOS
Ubicación y características del sitio de estudio
La laguna de Yahuarcocha está situada en el norte del Ecuador, en la provincia de Imbabura; geográficamente se ubica entre 00º 22’ 300 N y 78º 06’ 100 O a una altitud de 2 192 m s.n.m. Presenta una temperatura anual media de 20 a 25 °C [26], con una superficie 230 hectáreas, un máximo de 7.9 metros (m) de profundidad y 12.7 millones de metros cúbicos (m3) de agua [25]. La laguna se encuentra en un proceso acelerado de eutrofización promovido por la colonización de cianobacterias del género Cylindrospermopsis sp. y los altos valores de conductividad y alcalinidad [23].
En la laguna existen aproximadamente 19 especies de aves acuáticas, donde la especie predominante es la Focha Andina (Fulica ardesiaca), y el Cormorán Neotropical (Phalacrocorax brasilianus) [22]. La vegetación superficial está dominada por la Totora (Scirpus californicus) y la vegetación acuática por Potamogeton pusillus [26]. La fauna íctica está compuesta por especies introducidas como: el pez cola de espada (Xiphophorus hellerii), el pez Guppy (Poecilia reticulata), la carpa común (Carassius auratus) y la Tilapia del Nilo (Oreochromis niloticus) [27].
Método de muestreo
La colecta de muestra fecal por especie se realizó en marzo del 2018 en cuatro días con un esfuerzo total de 12 horas (3h/jornada). La captura de las aves se realizó a través de un método combinado de trampas de red, distracción lumínica nocturna [28], y captura manual directa en los dormideros con el uso de un bote acuático entre las 20h00 a 23h00. Las aves capturadas fueron colocadas en jaulas tipo huacal hasta ser examinadas
y manipuladas. Cada individuo fue marcado con un anillo auxiliar de color previo a la liberación para evitar el doble muestreo. Las heces de todas las aves fueron colectadas de forma individual (3-5 g) en el sitio de estudio en la jaula de descanso por defecación espontánea en un tiempo máximo de 10 minutos, y no se administró ningún tipo de fármaco para la obtención de las muestras. Previo a la liberación de los individuos en los sitios de captura, se realizó un examen físico externo a cada ave para asegurar su bienestar. Ningún ave tuvo signos de traumatismos externos o visibles al momento de la examinación y posterior liberación.
Métodos de diagnóstico y cuantificación
Para la identificación y cuantificación de parásitos gastrointestinales se obtuvo una muestra de heces de al menos 4 g, de los cuales se utilizó al menos 1 g para la técnica directa o frotis fecal fresco y 3 gramos para la cuantificación parasitaria por la Técnica de McMaster [29,30,31,32]. Para realizar el frotis fecal fresco se colocaron por separado una gota de solución salina (0,85 %) y una gota de solución de Lugol (4 %) en un portaobjetos. Colocamos una pequeña cantidad de heces, la mezclamos de forma independiente con cada gota y cubrimos la muestra con un cubreobjetos. Los portaobjetos con el frotis fecal fresco se llevaron al microscopio y se examinaron con un aumento total de 100x y 400x para verificar las especies parasitarias [33].
Para el procesamiento de muestras fecales mediante el método McMaster preparamos una suspensión de heces (2 gramos) con 28 ml de solución de flotación SF5 - solución Sheater (454 g NaCl + 355 ml de agua + 6 ml de formaldehído, gravedad específica 1,25 mg/dl) para cada muestra. Homogeneizamos cuidadosamente la muestra fecal durante aproximadamente 30 segundos (dependiendo de la consistencia de la muestra) mezclándola con una espátula de madera, y pasándola por un colador. Utilizando una pipeta Pasteur, en un ángulo de 45 grados, trasladamos la solución obtenida previamente a cada una de las cámaras. Dejamos que los huevos floten 5 minutos y se peguen a la rejilla. Luego miramos bajo el microscopio; el valor total de huevos de cada cámara fueron sumados y multiplicados por un factor de cincuenta (50) para obtener el número de huevos por gramo de heces (HPG) o de ooquistes por gramo de heces (OPG) [34].
Análisis estadístico
Todos los datos se ingresaron en un archivo de Excel (Microsoft 2010). El análisis estadístico se realizó utilizando la versión R-4.2.3. Las especies de aves se trataron como variables categóricas y se presentaron como frecuencias y porcentajes. Cada muestra fue procesada por cada método diagnóstico; la muestra que resultó positiva con cualquiera de los métodos se consideró como verdadero positivo. La variable de respuesta para el modelo de prevalencia de parásitos gastrointestinales comprendía la ausencia o presencia de cualquier género de parásito dentro de cada huésped; la intensidad de la infección se determinó como el número de huevos/ooquiste por gramo de heces; y la coinfección como el número de huevos/ooquistes combinados dentro de cada individuo o de cada individuo infectado. La intensidad de infección fue evaluada considerando los rangos de estimación propuestos por Sabatini et, al. [34]. siendo: leve (< 200 HPG/OPG), moderada (> 200-800 HPG/OPG), y alta (> 800 HPG/OPG).
Resultados
El total de aves capturadas fue 48, de las cuales: el Cormorán neotropical (17/48), Gallinula chloropus (5/48), Oxyura jamaicensis (5/48), Fulica ardesica (18/48) y Bulbucus ibis (3/48). La prevalencia fue del 48 % (23/48), con al menos un género parasitario. Por especie, la mayor prevalencia corresponde a la Gallineta común 60 % (3/5); seguido de la Focha andina 50 % (9/18), el Cormorán Neotropical 47 % (8/17), el Pato rojizo andino 40 % (2/5) y la Garza bueyera 33 % (1/3) (Tabla 1, Figura 1). Se identificaron cuatro géneros de parásitos; dos a nivel de especie agrupados en tres familias: Ascarididae; Trichinellidae, Eimeriidae (Figura 2)
Tabla 1. Prevalencia de parásitos gastrointestinales en cinco especies de aves de acuáticas de la laguna Yahuarcocha, Imbabura.
| Especie/ hospedador | Nombre común | Total -individuos | N individuos parasitados | Prevalencia /sp. |
| Phalacrocorax brasilianus | Cormorán neotropical | 17 | 8 | (47 %) |
| Gallinula chloropus | Gallineta común | 5 | 3 | (60 %) |
| Oxiura jamaicences | Pato rojizo andino | 5 | 2 | (40 %) |
| Fulica ardesiaca | Focha andina | 18 | 9 | (50 %) |
| Bulbucus ibis | Garza bueyera | 3 | 1 | (33 %) |
| Total | 48 | 23 |
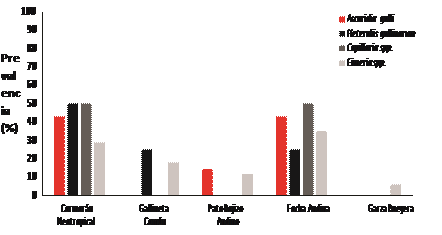
Figura 1
Prevalencia de parásitos gastrointestinales en cinco especies de aves acuáticas de la laguna Yahuracocha, Imbabura, Ecuador.
Hospedador
Figura 1. Prevalencia de parásitos gastrointestinales en cinco especies de aves acuáticas de la laguna Yahuracocha, Imbabura, Ecuador.
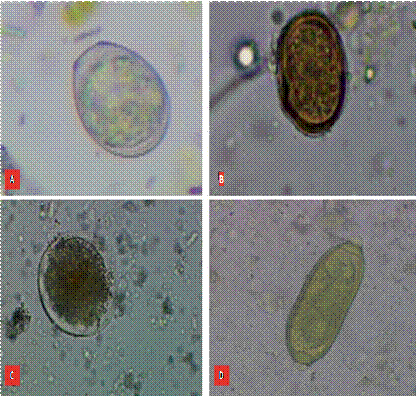
Figura 2
Identificación microscópica (40 x) de endoparásitos en aves acuáticas de la laguna Yahuacorcha,
Figura 2. Identificación microscópica (40 x) de endoparásitos en aves acuáticas de la laguna Yahuacorcha,
Imbabura, Ecuador: (A) Ascaridia galli (FC-Y-40); (B) Capillaria spp. (COR-Y-2); (C) Eimeria spp (FC-Y-14); (D) Heterakis gallinarum (COR-Y-29)
Con respecto a la frecuencia; Eimeriasp. (17/23) estuvo presente en las cinco especies hospedadoras con valores de: 35 % (6/17) en la Focha andina, 29 % (5/17) en Cormorán neotropical, y porcentajes más bajos estimados en los tres restantes. Así mismo, A. galli estuvo presente en tres de las cinco especies hospedadoras con 43 % (3/7) tanto en el Cormorán neotropical, como en la Focha andina, y 14,3 % (1/7) en el Pato rojizo andino (Figura 2).
Heterakis gallinarum tuvo un rango de frecuencia de 25 % a 50 % en tres especies hospedadores: 50 % (2/4) en el Cormorán neotropical y 25 % (1/4) en Focha andina y Gallineta común.; finalmente Capillaria sp. obtuvo 50 % (1/2) en el Cormorán neotropical y en la Focha andina. Adicionalmente, se presentaron infecciones mixtas en siete individuos de cuatro especies, excepto en la Garza bueyera. Las infecciones mixtas identificadas fueron: A. galli + Capillaria sp. (1/7), Heterakies sp. + Eimeria spp. (3/7), Capillaria sp. + Eimeria spp (1/7), A. galli + Eimeria spp. (2/7) (Tabla 2).
Tabla 2. Frecuencia de parasitismo e infecciones mixtas de parásitos gastrointestinales en cinco especies de aves acuáticas de la laguna de Yahuarcocha, Imbabura.
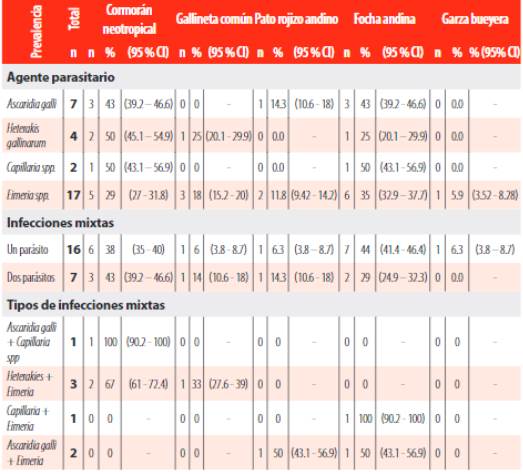
Tabla 2
Frecuencia de parasitismo e infecciones mixtas de parásitos gastrointestinales en cinco especies de aves acuáticas de la laguna de Yahuarcocha, Imbabura.
Con respecto a la intensidad de infestación, las aves presentaron valores promedio de 271 (±74) huevos por gramo de heces (HPG) de A. galli; 275(±98) HPG de H. gallinarum; 125 (±25) HPG de Capillaria sp. y de 236 (±139) ooquistes por gramo (OPG) de Eimeria spp. Las cinco especies hospedadoras presentaron un nivel de infestación de leve (<200 HPG) a moderada (>200-800 HPG/OPG). Para Eimeria spp., el Pato rojizo andino obtuvo el mayor número de ooquistes (600 OPG). Por el contrario, observamos que la parasitosis producida por A. galli fue moderada en la Focha andina (600 HPG), leve para el Pato rojizo andino (150 HPG) y el Cormorán neotropical (200 HPG). H. gallinarum tuvo infestación moderada en la Gallineta común (400 HPG), mientras que, en la Focha andina y en el Cormorán neotropical, la parasitosis fue leve (200 HPG). Capillaria sp. se presentó en dos especies con infestación leve: Cormorán neotropical (100 HPG) y Focha andina (150 HPG) (Tabla 3).
Tabla 3. Intensidad de infestación (HPG/OPG) de parásitos gastrointestinales en cinco especies de aves silvestres en la laguna de Yahuarcocha.
| Agente parasitario | Total Ind. | Phalacrocorax b. | Gallinula chl | Oxiura J. | Fulica A. | ||||
| n | HPG/OPG | n | HPG/OPG | n | HPG/OPG | n | HPG/OPG | ||
| Ascaridia galli | 7 | 1 | 150 | 0 | - | 1 | 200 | 1 | 100 |
| 1 | 150 | - | - | - | - | 1 | 600 | ||
| 1 | 200 | - | - | - | - | 1 | 500 | ||
| Heterakis gallinarum | 4 | 2 | 150 | 1 | 400 | 0 | 0 | 1 | 200 |
| 200 | - | - | - | - | - | - | |||
| Capillaria spp. | 2 | 1 | 150 | 0 | - | 0 | 0 | 1 | 100 |
| Eimeria spp. | 19 | 1 | 100 | 1 | 100 | 1 | 100 | 12 | 150 |
| 1 | 400 | - | - | - | - | - | - | ||
| - | - | - | 1 | 300 | - | - | |||
| 1 | 300 | 2 | 250 | 1 | 200 | 2 | 200 | ||
| 3 | 400 | 3 | 300 | 3 | 300 | 3 | 300 | ||
| 4 | 500 | - | - | 4 | 600 | - | - | ||
DISCUSIÓN
En este estudio se identificaron cuatro géneros de parásitos en cinco especies de aves silvestres. Géneros de parásitos como A. galli y H. gallinarum han sido descritas en estudios previos en aves de la especie F. ardesiaca [32]; adicionalmente, se conoce que en la zona de los trópicos los parásitos de este género, así como otros del género Capillaria sp. son diagnosticados con mucha frecuencia en aves de la familia gallinácea [33,34]. Por el contrario, parásitos del género Eimeria spp. pueden presentar una amplia diversificación según el hospedador, ya sean estas: aves silvestres de ambientes acuáticos, como el Cormorán de doble cresta (Phalacrocorax auritus) hospedador de Eimeria auritusi; aves terrestres como el Gallipavos (Meleagris gallopavo silvestris) hospedador de E. gallopavonis [35,36]; o aves de producción donde puede encontrarse al menos siete especies del género Eimeria spp. [37,38].
Nuestros resultados muestran que el género Eimeria spp. fue el parásito con mayor prevalencia dentro de las cinco especies hospedadoras, con un rango de variación desde el 20 % hasta el 60% de prevalencia. Un valor de prevalencia mayor (96 %) ha sido determinado en aves silvestres en sistemas de cautiverio [39]. Este hallazgo puede considerarse esperado, considerando que el género Eimeria es muydiverso entre localidades, formas de producción [40] y hospedadores. Por ejemplo, se han citado algunos géneros que son capaces de producir coccidiosis en aves comerciales; entre ellas: Eimeria brunetti, Eimeria necatrix y Eimeria tenella [41]. Adicionalmente, se ha determinado coccidiosis severa y moderada en la Grulla trompetera (Grus americana) producida por Eimeria gruis y Eimeria reichenowi [42] y una posible mortalidad en Cormoranes de doble cresta producido por Eimeria auritusi [43].
Por otro lado, observamos que las especies A. galli, H. gallinarum y el género Capillaria spp. afectaron en menor proporción a los hospedadores estudiados, estando ausentes en algunos de ellos; las especies de este género de parásito afecta tanto a aves de hábitos acuáticos (Podiceps major) como a aves terrestres (Columbia livia) [44,45].
La presencia de las especies del género Capillaria spp. descritos en el presente estudio tiene concordancia con los resultados de los estudios realizados por Padilla-Aguilar et al. en aves acuáticas, que incluyen dos géneros de hospedador de este estudio (Fulica americana y Oxyura jamaicenses) [46]. Sin embargo, a nivel de diversidad de parásitos, nuestros hallazgos contrastan con el estudio en mención, ya que no identificamos otras familias parasitarias como la Tremátoda y Acantocephala [46].
Si bien es cierto que este estudio muestra una estimación de la carga parasitaria en los hospedadores, es necesario aclarar las limitaciones de las técnicas utilizadas; principalmente para la identificación y el conteo por el método de McMaster, ya que, autores como Sabatini, et al. y Paras, et al. [34,47], manifiestan que esta puede ser reemplazada por el método de Wisconsin o el método de Mini-FLOTAC que incrementan la probabilidad de un mayor conteo de HPG u OPG.
Entender la dinámica parasitaria de las aves acuáticas involucra otros factores tales como: los hábitos alimenticios, los movimientos de las aves, las interacciones interespecíficas, y los factores de hábitat tal que la calidad de agua y la producción del ecosistema [48]; variables no analizadas en este estudio y que proporcionarían nuevas rutas para explicar el estado y la salud de las especies aviares y su hábitat.
AGRADECIMIENTOS
Agradecemos a Héctor Cadena por la revisión al manuscrito. A la Dirección de Investigación de la Universidad Central por el financiamiento (Proyecto DGI 42). Al Ministerio del Ambiente por los permisos de investigación de la provincia de Imbabura No. 11-2016-1898-IC-FAU-FLO-DPAI/MAE). A la estación de bomberos de Yahuarcocha por el apoyo logístico en terreno. A Dana Luzuriaga y Edwin Reyes por la asistencia durante el trabajo de campo.
CONTRIBUCIONES DE LOS AUTORES
N. Luzuriaga gestionó la adquisición de los fondos, la investigación, la conceptualización y la escritura del primer original; F. Pazmiño realizó la revisión y análisis estadístico; I. Flores, K. Mena y N. Reyes realizaron la metodología, el análisis de muestras y la revisión de resultados; L. Cedeño realizó la revisión del contenido y el trabajo en campo; A. LuzuriagaNeira realizó la revisión del contenido teórico y colaboró en los trabajos de muestreo.
CONFLICTO DE INTERÉS
Los autores declaran no tener conflictos de interés sobre esta investigación.
Agradecimientos
Agradecemos a Héctor Cadena por la revisión al manuscrito. A la Dirección de Investigación de la Universidad Central por el financiamiento (Proyecto DGI 42). Al Ministerio del Ambiente por los permisos de investigación de la provincia de Imbabura No. 11-2016-1898-IC-FAU-FLO-DPAI/MAE). A la estación de bomberos de Yahuarcocha por el apoyo logístico en terreno. A Dana Luzuriaga y Edwin Reyes por la asistencia durante el trabajo de campo.
REFERENCIAS
[1] Amundson, C.L., Traub, N.J., Smith-Herron, A.J. y Flint, P.L. (2016). Helminth community structure in two species of arctic-breeding waterfowl. International Journal for Parasitology: Parasites and Wildlife, 5(3), 263–72. doi: https://doi.org/10.1016/j.ijppaw.2016.09.002
[2] Poulin, R. (1999). The functional importance of parasites in animal communities: Many roles at many levels? International Journal for Parasitology, 29(6), 903–14. doi: https://doi.org/10.1016/S0020-7519(99)00045-4
[3] Cross, J.H. (1992). Intestinal Capillariasis. American Society for Microbiology, 5(2), 120–9. https://journals.asm.org/ doi/10.1128/CMR.5.2.120
[4] Bajer, A., Alsarraf, M., Dwużnik, D., Mierzejewska, E.J., Kołodziej-Sobocińska, M. y Behnke, J.M. (2020). Rodents as intermediate hosts of cestode parasites of mammalian carnivores and birds of prey in Poland, with the first data on the life-cycle of Mesocestoides melesi. Parasites and Vectors, 13(1),1–10. doi: https://doi.org/10.1186/s13071-020-39612
[5] Valtonen, E.T., Holmes, J.C. y Koskivaara, M. (2011). Eutrophication, pollution, and fragmentation: Effects on parasite communities in roach (Rutilus rutilus) and perch (Perca fluviatilis) in four lakes in central Finland. Canadian Journal of Fisheries and Aquatic Sciences, 54, 572–85. http://www.nrc.ca/cgi-bin/cisti/journals/rp/rp2_abst_e?cjfas_f96306_54_ns_nf_cjfas54-97
[6] Mercado-Reyes, M., Angulo-Casillo, S.A., Clemente–Sánchez, F., Hernández-Llamas, A., Gonzáles–Rojas, I., López– Torres, E. y Tavizón–García, P. (2010). Presence of Helminths in the Mexican Duck (Anas platyrhynchos diazi) of the Zacatecano Plateau, México. Agrociencia. 44(8), 931–9. https://www.scielo.org.mx/scielo.php?script=sci_ arttext&pid=S1405-31952010000800006
[7] Salgado-Maldonado, G., Caspeta-Mandujano, J. M., Martínez-Ramírez, E., Montoya-Mendoza, J. y Mendoza-Franco, E. F. (2020). Diversity of helminth parasites of freshwater fish in the headwaters of the Coatzacoalcos River, in Oaxaca, Mexico. International Journal for Parasitology: Parasites and Wildlife, 12(5), 142–149. doi: https://doi.org/10.1016/j. ijppaw.2020.05.008
[8] Leiva, N., George-Nascimento, M. y Muñoz, G. (2015). Carga parasitaria en crustáceos decápodos de la costa central de Chile: ¿existe alguna asociación con la abundancia de los hospedadores definitivos? Latin american journal of aquatic research, 43(4), 726–738. doi: https://doi.org/10.3856/vol43-issue4-fulltext-11
[9] Rubio-Godoy, M., de León, G.P.P., Mendoza-Garfias, B., Carmona-Isunza, M.C., De la Mora, A.N. y Drummond, H. (2011). Helminth Parasites of the Blue-Footed Booby on Isla Isabel, México. Journal of Parasitology, 97(4), 636–41. doi: http://dx.doi.org/10.1645/GE-2675.1
[10] Santoro, M., D’Alessio, N., Di Prisco, F., Veneziano, V., Galiero, G., Cerrone, A., Barca, L., Kinsella, J. y Aznar, F.J. (2016). Helminth communities of herons (Aves: Ardeidae) in southern Italy. Parasitology International, 65(4), 340–6. doi: http://dx.doi.org/10.1016/j.parint.2016.04.002
[11] Drago, F. B., Núñez, V. y Díaz, M. D. (2020). Checklist of the nematode parasites of wild birds of Argentina. Revue Suisse de Zoologie, 127(1), 43. doi: https://doi.org/10.35929/RSZ.0005
[12] Hinojosa-Sáez, A. y González-Acuña, D. (2005). Estado actual del conocimiento de helmintos en aves silvestres de Chile. Gayana (Concepción), 69(2), 241–253. doi: https://doi.org/10.4067/s0717-65382005000200004
[13] Ortega-Olivares, M.P., Barrera-Guzmán, A.O., Haasová, I., Salgado-Maldonado, G., Guillén-Hernández, S. y Scholz, T. (2008). Tapeworms (Cestoda: Gryporhynchidae) of Fish-Eating Birds (Ciconiiformes) from Mexico: New Host and Geographical Records. Comparative Parasitology, 75(2), 182–95. doi: https://doi.org/10.1654/4346.1
[14] Ribeiro Machado, A.C., Lima, O.M. y de Barros Araújo, J.L. (2007). Helmintos Parasitosem Aves Anseriformesque Ocorrem Em Goiás. Revista de Patologia Tropical, 35(3), 185–198. doi: https://doi.org/10.5216/rpt.v35i3.1879
[15] Ensuncho Hoyos, C., Herrera Benavides, Y., Montalvo Puente, A., Almanza Palencia, M., Vergara Álvarez, J., Pardo-Rada, L. y Gómez Mercado, L. (2015). Frecuencia de parásitos gastrointestinales en gallinas criollas (Gallus domesticus) en el departamento de Córdoba, Colombia. Revista Electronica de Veterinaria, 16(6). http://www.veterinaria.org/revistas/redvet/n060615.html
[16] Ensuncho Hoyos, C.F., Herrera Benavides, Y.M. y Vergara Garay, Ó.D. (2016). Primer registro de Typhlocoelum cucumerinum (Trematoda: Typhlocoelidae) en Cairina moschata domestica (aves: Anatidae) en Colombia. Revista de Medicina Veterinaria, 33(33), 35–41. https://www.semanticscholar.org/paper/Primer-registro-de-Typhlocoelumcucumerinum-en-en-Hoyos-Benavides/98627448f0fcf6aa10eb64771159295183deee7a
[17] Carrera-Játiva, P.D., Rodríguez-Hidalgo, R., Sevilla, C., y Jiménez-Uzcátegui, G. (2014). Gastrointestinal parasites in the Galápagos Penguin Spheniscus mendiculus and the flightless cormorant Phalacrocorax Harrisi in the Galápagos Islands. Marine Ornithology, 42(1), 77–80.
[18] Jiménez-Uzcátegui, G., Sarzosa, M.S., Encalada, E., Rodríguez-Hidalgo, R., Celi-Erazo, M. y Huyvaert, K.P. (2015). Gastrointestinal parasites in the waved albatross (Phoebastria irrorata) of galápagos. Journal of Wildlife Diseases, 51(3), 784–786. doi: https://doi.org/10.7589/2014-06-165
[19] Pardo-Lalvay, A.F., Mendoza-León, C. y Carrera-Játiva, P.D. (2021). Endoparasites in the Synanthropic Feral Pigeon (Columba livia Domestica) in Southern Ecuador. Journal of Zoo and Wildlife Medicine, 52(3), 1003–8. doi: https://doi.org/10.1638/2020-0233
[20] Guevara, E.A., Santander G., T., Espinosa, R. y Graham, C.H. (2021). Aquatic bird communities in Andean lakes of Ecuador are increasingly dissimilar over time. Ecological Indicators, 121, 107044. doi: https://doi.org/10.1016/j.ecolind.2020.107044
[21] Guevara, E.A., Santander, T. y Duivenvoorden, J.F. (2012). Seasonal Patterns in Aquatic Bird Counts at Five Andean Lakes of Ecuador. Waterbirds, 35(4), 636–41. http://www.bioone.org/doi/abs/10.1675/063.035.0413
[22] Van Colen, W., Portilla, K., Oña, T., Wyseure, G., Goethals, P., Velarde, E. y Muylaert, K. (2017). Limnology of the neotropical high elevation shallow lake Yahuarcocha (Ecuador) and challenges for managing eutrophication using biomanipulation. Limnologica, 67, 37–44. doi: http://dx.doi.org/10.1016/j.limno.2017.07.008
[23] Jácome, G., Valarezo, C. y Yoo, C. (2018). Assessment of water quality monitoring for the optimal sensor placement in lake Yahuarcocha using pattern recognition techniques and geographical information systems. Environmental Monitoring and Assessment, 190(4), 259. doi: https://doi.org/10.1007/s10661-018-6639-x
[24] Saelens, P. (2015). Ecological functioning of a eutrophic, high-altitude shallow lake in Ecuador, Laguna Yahuarcocha. KU Leuven Kulak. https://scriptiebank.be/scriptie/2015/ecological-functioning-eutrophic-high-altitude-shallow-lakeecuador-laguna
[25] Maridueña, A., Chalén, D., Coello, J., Elías, E., Solís-Coello, P., and Aguilar, F. (2011). Mortandad de peces en la laguna de Yahuarcocha, cantón Ibarra, provincia de Imbabura. Boletín Especial, 2(1), 128. https://aquadocs.org/handle/1834/4501
[26] Terneus, E. (2014). Vegetación acuática y estado trófico de las lagunas andinas de San Pablo y Yahuarcocha, provincia de Imbabura, Ecuador. Revista Ecuatoriana De Medicina Y Ciencias Biológicas, 2, 121–31. doi: https://doi.org/10.26807/remcb.v35i1-2.255
[27] Benavides, C. (2021). Evaluación de la diversidad ictiológica del lago Yahuarcocha, provincia de Imbabura. Repositorio digital Universidad Técnica del Norte. http://repositorio.utn.edu.ec/handle/123456789/11753
[28] Benítez-López, A., Mougeot, F., Martín, C.A., Casas, F., Calero-Riestra, M., García, J. y Viñuela, J. (2011). An improved night-lighting technique for the selective capture of sandgrouse and other steppe birds. European Journal of Wildlife Research, 57(2), 389–93. doi: https://doi.org/10.1007/s10344-010-0437-2
[29] Bowman, D. (2010). Georgi. Parasitología para veterinarios. Elsevier Health Sciences. https://books.google.com.ec/books/about/Georgi_Parasitolog%C3%ADa_para_veterinarios.html?id=vddwEAAAQBAJ&redir_esc=y https://inspectioncopy.elsevier.com/book/details/9788413822501
[30] Thienpont, D., Rochette, F. y Vanparijs, O.F.J. (1979). Diagnóstico de las helmintiasis por medio del examen coprológico. Janssen Research Foundation. https://search.worldcat.org/es/title/diagnostico-de-las-helmintiasis-por-medio-delexamen-coprologico/oclc/1024602266
[31] Zajak, A. y Conboy, G. (2012). Fecal Examination for the Diagnosis of Parasitism. In Gary A. C. (Ed.), Veterinary Clinical Parasitology (pp. 3–164). Wiley-Blackwell. www.wiley.com/go/zajac
[32] Cruz, G. (2016). Estudio compartivo de ecto y endoparásitos en Gallus gallus y Fulica ardesiaca, en la Laguna Cola, Riobamaba. Universidad Central del Ecuador.
[33] Organización Mundial de la Salud. (1992). Métodos básicos de laboratorio en parasitología médica. Organización Mundial de la Salud. https://iris.who.int/handle/10665/38858
[34] Sabatini, G. A., de Almeida Borges, F., Claerebout, E., Gianechini, L. S., Höglund, J., Kaplan, R. M., Lopes, W. D. Z., Mitchell, S., Rinaldi, L., von Samson-Himmelstjerna, G., Steffan, P. y Woodgate, R. (2023). Practical guide to the diagnostics of ruminant gastrointestinal nematodes, liver fluke and lungworm infection: interpretation and usability of results. Parasites and Vectors, 16(1), 58. doi: https://doi.org/10.1186/s13071-023-05680-w
[36] Macdonald, A.M., Jardine, C.M., Rejman, E., Barta, J.R., Bowman, J. y Nemeth, N.M. (2019). High prevalence of Mycoplasma and Eimeria species in free-ranging eastern wild turkeys (Meleagris gallopavo silvestris) in Ontario, Canada. Journal of Wildlife Diseases, 55(1), 54–63. doi: https://doi.org/10.7589/2017-11-273
[37] López-Osorio, S., Chaparro-Gutiérrez, J.J. y Gómez-Osorio, L.M. (2020). Overview of Poultry Eimeria Life Cycle and Host-Parasite Interactions. Frontiers in Veterinary Science, 7. 1–8. doi: https://doi.org/10.3389/fvets.2020.00384
[38] Rotolo, J.L., Snyder, R.P., Imai, R.K., Répérant, J.M. y Barta, J.R. (2021). Description of a New Eimeria Species (Apicomplexa: Eimeriidae) Responsible for Clinical Coccidiosis in Commercial Chukar Partridge (Alectoris chukar). Journal of Parasitology, 107(4), 648–57. doi: https://doi.org/10.1645/21-17
[39] Corredor, D.J.G., Parada, O.J.S., Medellín, M.O.P. y Becerra, R.J.A. (2013). Identificación de parásitos gastrointestinales en aves silvestres en cautiverio. Revista Cientifica de la Facultad de Ciencias Veterinarias de la Universidad del Zulia, 23(3), 254-258. https://www.redalyc.org/articulo.oa?id=95926665004
[40] Chengat Prakashbabu, B., Thenmozhi, V., Limon, G., Kundu, K., Kumar, S. y Blake, D.P. (2017). Eimeria species occurrence varies between geographic regions and poultry production systems and may influence parasite genetic diversity. Veterinary Parasitology, 233, 62–72. https://www.sciencedirect.com/science/article/pii/S0304401716305040
[41] Mesa, C., Gómez-Osorio, L.M., López-Osorio, S., Williams, S.M. y Chaparro-Gutiérrez, J.J. (2021). Survey of coccidia on commercial broiler farms in Colombia: frequency of Eimeria species, anticoccidial sensitivity, and histopathology. Poultry Science, 100(8), 101239. https://www.sciencedirect.com/science/article/pii/S003257912100273X
[42] Bertram, M.R., Hamer, G.L., Snowden, K.F., Hartup, B.K. y Hamer, S.A. (2015). Coccidian Parasites and Conservation Implications for the Endangered Whooping Crane (Grus americana). PLoS ONE, 10(6), e0127679. doi: https://doi.org/10.1371/journal.pone.0127679
[43] Yabsley, M.J. y Gibbs, S.E.J. (2006). Description and phylogeny of a new species of Eimeria from Double-crested Cormorants (Phalacrocorax auritus). Journal of Parasitology, 92(2), 385–8. doi: https://doi.org/10.1645/GE-592R.1
[44] Pérez-García, J., Monsalve-Arcila, D. y Márquez-Villegas, C. (2015). Presencia de parásitos y enterobacterias en palomas ferales (Columba livia) en áreas urbanas en Envigado, Colombia. Revista Facultad Nacional de Salud Pública, 33(3), 370–376. doi. https://doi.org/10.17533/udea.rfnsp.v33n3a06
[45] Martinez-Haro, M., Sanchez-Nava, P., Salgado-Maldonado, G., and Rodriguez-Romero, F. de J. (2012). Helmintos gastrointestinales en aves acuaticas de la subcuenca alta del río Lerma, Mexico. Revista Mexicana de Biodiversidad, 83(1), 36–41. http://www.ibiologia.unam.mx
[46] Padilla-Aguilar, P., Romero-Callejas, E., Osorio-Sarabia, D., Pérez-Ponce De León, G. y Alcalá-Canto, Y. (2020). New records of helminth parasites of nine species of waterfowl in Mexico, and a checklist of the helminth fauna of Anatidae occurring in Mexican wetlands. Journal of Helminthology, 93, 1-15. doi: https://doi.org/10.1017/S0022149X20000577
[47] Paras, K., George, M. , Vidyashankar, A. y Kaplan, R. M. (2018). Comparison of fecal egg counting methods in four livestock species. Veterinary Parasitology, 257, 21–27. doi: https://doi.org/10.1016/j.vetpar.2018.05.015
[48] Laurance, S. G. W., Jones, D., Westcott, D., Mckeown, A., Harrington, G. y Hilbert, D. W. (2013). Habitat Fragmentation and Ecological Traits Influence the Prevalence of Avian Blood Parasites in a Tropical Rainforest Landscape. PLoS ONE, 8(10), e76227. doi: https://doi.org/10.1371/journal.pone.0076227
Cervantes-Rivera, K., Villagómez-Cortés, J.A., Arroyo-Lara, A. y Landín-Grandvallet, L.A. (2016). A diagnostic survey of gastroenteric helminths in backyard poultry of a rural village in mexican tropics. ARPN Journal of Agricultural and Biological Science, 11(12), 463–470. https://www.arpnjournals.com/jabs/volume_12_2016.htm