Peces de la Laguna Cormorán, Parque Nacional Sangay, Ecuador
Fishes of Cormoran Lagoon, Sangay National Park, Ecuador
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
ISSN: 1390-5384
ISSN-e: 2528-7788
Periodicidad: Bianual
vol. especial, núm. 1, 2020
Recepción: 15 Abril 2016
Aprobación: 17 Abril 2017
Resumen: Se realizó un inventario de peces en la laguna Cormorán, en la zona ictiogeográfica Upano-Zamora, durante octubre 2011 (época de seca), febrero 2012 (época de transición) y mayo 2012 (época de lluvias). Los peces fueron muestreados usando cuatro trasmallos (20 m de largo, 1,5 m de alto), 40 anzuelos y una red de mano. Un total de 599 individuos de 16 especies y seis familias fueron capturados. El orden Characiformes fue el más abundante y diverso, y Lebiasina elongara (Lebiasinidae) y Astyanax fasciatus (Characidae) fueron las especies más abundantes. La abundancia de especies disminuyó paulatinamente conforme llegaba la época de lluvias. Se extienden los rangos altitudinales del género Chaetostoma (Chaetostoma microps) y de la familia Heptapteridae (Rhamdia quelen) hasta 1783 m en Ecuador. La ictiofauna de la laguna Cormorán todavía necesita mayores de estudios. Es necesario realizar estudios taxómicos, ecológicos y biogeográficos que contribuyan al conocimiento de la diversidad de peces de este ecosistema acuático tropical. Es posible que algunas especies encontradas en este estudio sean endémicas, especialmente en los géneros Astroblepus y Bryconamericus.
Palabras clave: Abundancia, Actinopterygii, diversidad, riqueza de especies, Upano-Zamora.
Abstract: I conducted a fish inventory at the Cormoran Lagoon, in the icthyogeographic area Upano-Zamora, during October 2011 (dry season), February 2012 (transition period), and May 2012 (rainy season). Fish were sampled using four trammels (20 m length, 1.5 m height), 40 fishing lines, and a hand net. A total of 599 individuals of 16 species and six families were captured. The order Characiformes was the most abundant and diverse, and Lebiasina elongata (Lebiasinidae) and Astyanax fasciatus (Characidae) were the most abundant species. Species abundance gradually decreased as the rainy season arrived. Elevational ranges of the genus Chaetostoma (Chaetostoma microps) and of the family Heptapteridae (Rhamdia quelen) are increased to 1783 m in Ecuador. Fish diversity at Cormoran Lagoon still needs more studies. It is necessary to carry out taxonomic, ecological, and biogeographic studies that contribute to the knowledge of fish diversity in this tropical aquatic ecosystem. It is posible that some species are endemic, specially in the genera Astroblepus and Bryconamericus.
Keywords: Abundance, Actinopterygii, diversity, species richness, Upano-Zamora.
INTRODUCCIÓN
Los estudios sobre la ictiofauna dulceacuícola en Ecuador se han incrementado en los últimos años, pese a ello, todavía existen considerables vacíos de información. A nivel sistemático hay varios géneros que solo han sido parcialmente revisados, especies conocidas solo por sus holotipos o con rangos de distribución pobremente documentada [1,2]. La mayor parte de estudios ictiológicos ecuatorianos provienen de pocas cuencas tradicionalmente estudiadas; i.e., las cuencas de los ríos Guayas, Esmeraldas, Napo y Pastaza. Existe un vacío en el conocimiento sobre los peces de las cuencas de ríos como Santiago, Morona, Upano y Zamora [3].
En la actualidad se ha registrado 944 especies de peces dulceacuícolas en Ecuador, destacándose la mayor diversidad de especies en la región Amazónica [4,5]. No obstante, esta cifra continúa incrementándose con el descubrimiento de especies nuevas y reportes de nuevos registros para Ecuador [6-13].
Barriga [4] agrupa a los 31 sistemas hidrográficos presentes en Ecuador en 11 zonas ictiohidrográficas, de acuerdo a la similitud y composición de sus comunidades de peces. Estas zonas ictiohidrográficas son el producto de varios factores evolutivos, orográficos, hidrográficos, físico-químicos, altitud y salinidad. En la región Amazónica se encuentran las zonas ictiogeográficas: Alto Napo, Alto Pastaza, Napo–Pastaza, Upano–Zamora y Morona–Santiago. Para la zona ictiogeográfica Upano–Zamora se estima la presencia de 40 especies de peces [4]. De este número, solo el 5% ha sido registrado en el complejo lacustre Sardinayacu [14]. En el presente estudio se contribuye al conocimiento de la ictiofauna de la laguna Cormorán, una de las lagunas menos exploradas y estudiadas del Ecuador y que forma parte del complejo lacustre Sardinayacu.
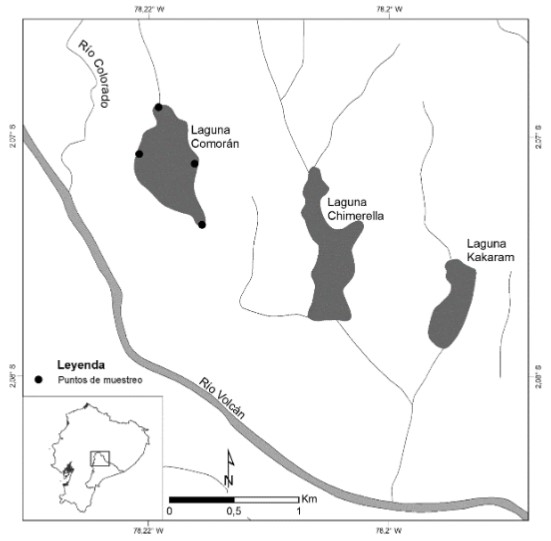
Figura 1
Figura 1
Localización de la laguna Cormorán, Complejo Lacustre Sardinayacu, Parque Nacional Sangay, Ecuador.

Figura 2
Figura 2
Laguna Cormorán, Complejo Lacustre Sardinayacu, Parque Nacional Sangay, Ecuador. (A) Vista panorámica; (B) vegetación emergente y sumergida. Fotografías: J. Brito (A) y F. Anaguano-Yancha (B).
MATERIALES Y MÉTODOS
La laguna Cormorán (−2.06981º, −78.2148º, 1783 m, Fig. 1–2) es una de las cinco lagunas que conforman el complejo lacustre Sardinayacu y está ubicada dentro del Parque Nacional Sangay. Tiene 875 m de largo, 425 m de ancho, una profundidad máxima de 25 m y sustrato limoso. La temperatura promedio de la zona limnética es de 21,4ºC, y el pH varía de 6,3 a 8,1; mientras que en la zona litoral, la temperatura es de 20,4 ºC y el pH de 6,5 a 8,3 [3]. La vegetación de la zona litoral corresponde a la formación vegetal de Herbazal Lacustre Montano Bajo de la Cordillera Oriental de los Andes y está constituida principalmente por especies de Cyperaceae y Onagraceae sumergidas en el agua, y Araceae y Poaceae que forman un cinturón entre el espejo de agua y el bosque (Fig. 2) [3, 14, 17–18]. Este sistema lentico es de formación relativamente temprana y se formó por la acción de un gran deslizamiento de lodo de las laderas del volcán Sangay que bloqueó la salida de agua de una gran cantidad de pequeños valles circundantes [15–16].La laguna se conecta con un afluente de tipo terciario del río Upano, es parte de la zona ictiogeográfica Upano-Zamora [4], y se ubica en el piso zoogeográfico Subtropical Oriental [5]. (Fig. 2)
La fase de campo de esta investigación se realizó en octubre 2011 (época seca), febrero 2012 (época de transición) y mayo 2012 (época de lluvias). Se estableció cuatro puntos de muestreo permanentes zonificados [19]. Para la captura de peces en la zona limnética y litoral se empleó: cuatro trasmallos de 20 m de largo por 1.5 m de alto, con ojo de malla de 0.025 m, los cuales permanecieron activos de 18h00 a 06h00, sumando un total de 216 horas efectivas de muestreo por punto; y 40 anzuelos Nº 12 distribuidos de manera equitativa en cada punto de muestreo permaneciendo activos de 11h00 a 13h00 con un total de 36 horas efectivas de muestreo para cada punto. Los márgenes de cada punto fueron muestreados mediante el empleo de una red de mano con ojo de malla de 5 mm, con la cual se realizó faenas de pesca de una hora dentro de un tramo de 100 m dando un total de 18 horas efectivas de muestreo por cada tramo.
Los peces capturados fueron registrados y fotografiados in situ para evitar la pérdida de su coloración natural al entrar en contacto con preservantes. Se realizó eutanasia a todos los especímenes usando solución analgésica de benzocaína de acuerdo con las directrices de la Asociación Americana de Medicina Veterinaria AVMA [20]. El manejo de especímenes se realizósiguiendo los protocolos establecidos por Maldonado-Ocampo et al. [21]. Los individuos fueron conservados en alcohol al 75% y depositados en la División de Peces del Museo Ecuatoriano de Ciencias Naturales del Instituto Nacional de Biodiversidad (DP-MECN). La identificación se realizó mediante la guía de campo de Rivadeneira et al. [22] junto con claves y revisiones taxonómicas disponibles para peces de la región Neotropical [1, 7, 11, 21, 23–28].
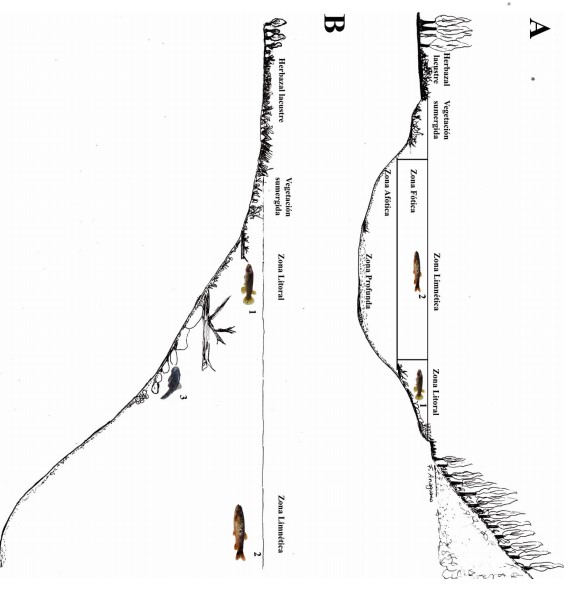
Figura 3
Figura 3
Distribución espacial de los peces en la laguna Cormorán, Complejo Lacustre Sardinayacu, Parque Nacional Sangay, Ecuador. Distribución horizontal (A): Individuos juveniles y adultos de Lebiasina elongata, Astyanax fasciatus y Astyanax sp., Astyanax bimaculatus, Bryconamericus sp., Ceratobranchia elitor, Hemybrycon sp., Knodus septentrionalis, Moenkhausia sp., Creagrutus muelleri, Rhamdia quelen, Chaetostoma microps, Astroblepus spp. y Anablepsoides urophtalmus. (1) Individuos adultos de Lebiasina elongata, Astyanax fasciatus y Astyanax sp. (2); Distribución Vertical (B): Especies superficiales (1 y 2) Lebiasina elongata, Astyanax fasciatus y Astyanax sp., Astyanax bimaculatus, Bryconamericus sp., Ceratobranchia elitor, Hemybrycon sp., Knodus septentrionalis, Moenkhausia sp., Creagrutus muelleri. y Anablepsoides urophtalmus, especies bentónicas (3) Rhamdia quelen, Chaetostoma microps y Astroblepus spp. Ilustraciones: F. Anaguano-Yancha.
El análisis sobre la distribución espacial de los peces se basó en los criterios propuestos por Schindler y Scheuerell [29]. El listado de especies sigue el sistema de clasificación propuesto Eschmeyer y Fog [30].

Figura 4
Figura 4
Especies registradas con presencia de huevos en la laguna Cormorán, Complejo Lacustre Sardinayacu, Parque Nacional Sangay, Ecuador, en mayo 2012: Chaetostoma microps (A), Lebiasina elongata (B), Anablepsoides urophthalmus (C), y Creagrutus muelleri (D). Fotografías: F. Anaguano-Yancha.
RESULTADOS
En la laguna Cormorán se encontró un total de 16 especies distribuidas en seis familias y tres órdenes (Tabla 1). Las especies identificadas en este estudio representan el 40% de las especies estimadas para la zona ictiogeográfica Upano–Zamora, el 25% parael Piso Subtropical Oriental, y el 1,7% de las especies registradas para Ecuador continental. La ictiofauna registrada en la laguna Cormorán desde el punto de vista biogeográfico es característica de ríos montanos y piemontanos. Los Characiformes presentaron la diversidad más alta con el 69% del total de especies, seguido de Siluriformes 25%, y Cyprinodontiformes (6%). La familia Characidae presentó la mayor riqueza de especies con un 63%, seguida por Astroblepidae con el 13%. Loricariidae, Lebiasinidae, Heptapteridae y Rivulidae presentan una baja riqueza de especies, contribuyendo juntas con el 24% del total. El órden Characiformes con el 83% del total de individuos fue el más abundante seguido por Cyprinodontiformes con el 10% y Siluriformes con el 7%. En cuanto a familias, Characide con el 48% del total fue la más abundante, siguida por Lebiasinidae (35%), Rivulidae (10%), Heptapteridae (5%), en tanto Loricariidae y Astroblepide aportaron con el 1%.
La diferencia de abundancia y riqueza en la zona litoral como en la zona limnética no fue notable entre épocas. Sin embargo, las capturas de individuos y el registro de especies fueron disminuyendo paulatinamente conforme llegó la época de lluvias. Las especies más abundantes en la zona litoral fueron: Anablepsoides uruphthalmus, Astyanax maximus, Rhamdia quelen, Ceratobranchia elitor, Lebiasina elongata, y Astyanaxbimaculatus. En la zona limnética las más abundantes fueron L. elongata y Astyanaxfasciatus(Tabla 1). La distribución espacial de las especies presenta una diferencia muy marcada. Enla zona litoral se encuentran larvas, juveniles y adultos de todas las especies. Sin embargo, se pueden notar patrones de distribución ya que Chaetostoma micropsylas especies del género Astroblepus únicamente habitan cerca al afluente y efluente donde el sustrato está constituido por grava y piedra. En la zona limnética únicamente se registraron adultos de L. elongata, A. fasciatus y Astyanax sp. Las especies de los géneros Astyanax, Bryconamericus, Ceratobranchia, Creagrutus, Hemibrycon, Knodus, Moenkhausia y Anablepsoides habitan exclusivamente en aguas superficiales, mientras C. microps, R. queleny especies del género Astroblepus son bentónicas (Fig. 3). En la época de aguas altas, mayo 2012, se registró hembras de C. muelleri, L. elongata, C. microps y A. urophthalmus con presencia de huevos (Fig. 4), sin embargo, no se estableció la etapa de maduración en la que se encontraban.

Figura 5
Figura 5
Peces de la laguna Cormorán, Complejo Lacustre Sardinayacu, Parque Nacional Sangay, Ecuador: A) Lebiasina elongata (DP-MECN 2201), B) Astyanax bimaculatus, C) Astyanax maximus (DP-MECN 2233), D) Astyanax fasciatus (DP-MECN 2230), E) Astyanax sp. (DP-MECN 2197), F) Bryconamericus sp. (DP-MECN 2198), G) Ceratobranchia elitor (DP-MECN 2199), H) Hemibrycon sp., I) Creagrutus muelleri (DP-MECN 2229), J) Moenkhausia sp., K) Knodus septentrionalis. (DP-MECN 2232), L) Rhamdia quelen, M) Astroblepus sp.1 (DP-MECN 2202), N) Astroblepus sp. 2 (DP-MECN 2203), O) Chaetostoma microps (DP-MECN 2206), P) detalle de la boca de Astroblepus sp.1 (DP-MECN 2204), Q) Anablepsoides urophthalmus (hembra) (DP-MECN 2208), R) (macho) (DP-MECN 2234) y S) detalle de la boca de Chaetostoma microps (DP-MECN 2206). Fotografías: F. Anaguano-Yancha.
DISCUSIÓN
La prevalencia de Characiformesen la laguna Cormorán se contrapone a los típicos patrones de diversidad y composición en comunidades de peces a más de 1100 m de altitud, donde hay una dominancia de Siluriformes [31, 32]. En las cuencas del Pastaza y Napo, en localidades a más de 1500 mde altitud, tan solo se han registrado siete especies—la mayoría del género Astroblepus [17, 33]. Rivadeneira et al. [22] reportaron que la distribución altitudinal de la familia Characidae en la cuenta del Alto Pastaza está restringida hasta los 1800 m. Sin embargo, es posible que el límite de distribución de la familia Characidae dentro de la zona ictiogeográfica Upano–Zamora se encuentre a 2000 m. Eesta familia está representada por 10 especies a 1783 m en la laguna Cormorán, pertenecientes a siete géneros, y es posible que especies de esta familia también hayan colonizado las restantes lagunas del complejo lacustre Sardinayacu.
Los géneros Astyanax, Bryconamericus, Hemibrycon, Ceratobranchia, Creagrutus y Moenkhausia presentan cuerpos fusiformes que les permite remontar las corrientes y han sido exitosos en dispersarse por los grandes ríos desde la baja Amazonía [21, 34]. La presencia de los géneros Astroblepus y Chaetostoma en la laguna Cormorán posiblemente está relacionada a la captura fluvial, estando distribuidos a lo largo de los Andes desde Venezuela hasta Bolivia [31, 33]. Chaetostoma y Astroblepus presentan adaptaciones morfológicas que les permiten adaptarse a hábitats diversos, como ventosas bucales y odontodes para adherirse y fijarse a las rocas, vejigas natatorias reducidas o atrofiadas para aumentar la densidad corporal, y en el caso de Astroblepus, una cintura pélvica móvil [21, 36–37]. En el caso de Chaetostoma, su distribución ha sido documentada desdeel nivel del mar (Ch. eptingi) hasta 1500 m (Ch. anomalum, Ch. branickii, Ch. dorsale) [35]. El registro de Chaetostomamicropsen el presente estudio incrementa el rango de distribución conocido para Chaetostomaen 283 m. En el caso de Astroblepus, la mayoría de las especies se distribuyen desde los 1000 m hasta los 3000 m [29]. En cuanto a los géneros Lebiasina y Anablepsoides, sus distribuciones han sido documentadas hasta los 2000 m [21,37], donde habitan en pequeñas quebradas de corriente lenta, debido a que no presentan adaptaciones morfológicas que les permita establecerse en ríos con turbulencia. Las especies de Heptapteridae están ampliamente distribuidas en ríos piemontamos hasta los 1000 m. [22], por lo que el registro de R.quelenamplía la distribución altitudinal de Heptapteridae para Ecuador en 783 m. La distribución de estos géneros en la laguna Cormorán puede deberse a captura fluvial, conforme los Andes se levantaban [21, 33]. Sin embargo, la dispersión de estos géneros es aúnpoco conocida, por lo cual es pertinente realizar estudios biogeográficos profundos, en especial en comunidades ícticas que habitan ambientes acuáticos localizados a más de 1000 m de altitud.
Petry[38] determinaron que la presencia de comunidades de plantas son un componente sumamente importante en los sistemas acuáticos. En la laguna Cormorán, las plantas emergentes y sumergidas crean un ambiente estructuralmente complejo para los peces al proporcionar hábitats adecuados para su desarrollo y alimentación. Así mismo, esas plantas generan modificaciones físicas y químicas del agua que afectan la estructura, distribución espacial y temporal, estrategias de movilidad y alimentación de las comunidades ícticas [29, 39–41]. Se presume que debido a las estrategias comportamentales (uso de refugios y migraciones temporales) y a las estrategias adaptativas (morfológicas y anatómicas) observadas en las especies ícticas de la laguna Cormorán, podría existir unamarcada especialización que podría traducirse en un alto nivel de endemismo en los géneros Astroblepus, Chaetostoma, Bryconamericus, Ceratobranchia y Rhamdia.
| Orden, Familia,Especie | Z. Litoral | Z. Limnética | Total | Técnica de captura | Tipo de especie | ||||
| ES | ET | ELL | ES | ET | ELL | ||||
| CHARACIFORMES Lebiasinidae Lebiasina elongata | 3 | 2 | 6 | 100 | 68 | 32 | 211 | Tr, Az | Pelágica |
| Characidae Astyanax fasciatus | 1 | 4 | 1 | 89 | 56 | 40 | 191 | Tr, Az | Pelágica |
| Astyanax bimaculatus | 4 | 3 | 2 | 0 | 0 | 0 | 9 | Rm | Pelágica |
| Astyanax maximus | 18 | 9 | 15 | 0 | 0 | 0 | 42 | Rm | Pelágica |
| Astyanax sp. | 0 | 1 | 2 | 2 | 1 | 4 | 10 | Tr, Az | Pelágica |
| Bryconamericus sp. | 2 | 3 | 1 | 0 | 0 | 0 | 6 | Rm | Pelágica |
| Ceratobranchia elitor | 6 | 4 | 7 | 0 | 0 | 0 | 17 | Rm | Pelágica |
| Hemybrycon sp. | 1 | 0 | 0 | 0 | 0 | 0 | 1 | Rm | Pelágica |
| Knodus septentrionalis | 0 | 0 | 3 | 0 | 0 | 0 | 3 | Rm | Pelágica |
| Moenkhausia sp. | 1 | 2 | 0 | 0 | 0 | 0 | 3 | Rm | Pelágica |
| Creagrutus muelleri | 2 | 0 | 3 | 0 | 0 | 0 | 5 | Rm | Pelágica |
| SILIRIFORMES Heptapteridae Rhamdia quelen | 11 | 8 | 9 | 0 | 0 | 0 | 28 | Rm | Bentónica |
| Loricariicade Chaetostoma microps | 3 | 2 | 1 | 0 | 0 | 0 | 6 | Rm | Bentónica |
| Astroblepidae Astroblepus sp.1 | 1 | 1 | 0 | 0 | 0 | 0 | 2 | Rm | Bentónica |
| Astroblepus sp.2 | 2 | 0 | 2 | 0 | 0 | 0 | 4 | Rm | Bentónica |
| CYPRINIDONTIFORMES Rivulidae Anablepsoides urophtalmus | 30 | 18 | 13 | 0 | 0 | 0 | 61 | Rm | Pelágica |
| Total | 85 | 57 | 65 | 191 | 125 | 76 | 599 | ||
Abundancia de las especies de peces registradas en la laguna Cormorán, zona ictiogeográfica Upano–Zamora, Ecuador. Época de muestreo: Época seca (ES), época de transición (ET); época lluviosa (ELL). Técnica de captura: trasmallo (Tr), anzuelos (Az), red demano (Rm).
AGRADECIMIENTOS
La Dirección Provincial del Ministerio de Ambiente de Morona Santiago otorgó la autorización de investigación científica N°. 14-2011-INVESTIGACIÓN-B-DPMS/MAE. D. Escobar-Camacho aportó con acertados comentarios para el mejoramiento del manuscrito. VictorLeón, responsable del Parque Nacional Sangay (Zona Baja) prestó las facilidades dentro del área a su cargo. J. Brito, D. Batallas, J. Palacios, I. Valencia y P. Macas colaboraron en las fases de campo. D. Paredes gentilmente realizó la Figura 1.
Referencias
Bertaco, V.A., & Malabarba, L. (2010). A review of the Cis-Andean species of Hemibrycon Günther (Teleostei: Cha-raciformes: Characidae: Stevardiinae), with description of two new species. Neotropical Ichthyology, 8(4), 737-770. DOI: http://dx.doi.org/10.1590/S1679-62252010000400005
Román-Valencia, C., García, M., & Ortega, H. (2011). Revisión taxonómica y geográfica de Bryconamericus peruanus (Teleostei, Characidae). Revista Mexicana de Biodiversidad, 82(3), 844-853. URL: http://revista.ib.unam.mx/index.php/bio/article/view/726
Anaguano-Yancha, F. (2013). Diversidad de peces en la laguna y río Cormorán, Complejo Lacustre Sardinayacu, Parque Nacional Sangay, Provincia Morona Santiago-Ecuador (Tesis de Licenciatura). Universidad Central de Ecuador, Quito.
Barriga, R. (2012). Lista de Peces Dulceacuícolas e Intermareales del Ecuador. Revista Politécnica, 30(3), 83-119. URL: http://bibdigital.epn.edu.ec/handle/15000/5068
Albuja, L., Almendáriz, A., Barriga, R., Montalvo, L.D., Cáceres, F., & Román, J.L. (2012). Fauna de Vertebrados del Ecuador. Quito: Instituto de Ciencias Biológicas, Escuela Politécnica Nacional. URL: http://bibdigital.epn.edu.ec/handle/15000/5612
Wijkmark, N., Kullander S.O., & Barriga, R. (2012). An-dinoacara blombergi, a new species from the río Esmeraldas basin in Ecuador and a review of A. rivulatus (Teleostei: Ci- chlidae). Ichthyological Exploration Freshwaters, 23(2), 117137. URL: http://www.pfeil-verlag.de/04biol/pdf/ief23_2_05.pdf
Román-Valencia, C., Ruiz, R., Taphorn, D., & García, C. (2013). Three new species of Bryconamericus (Characifor- mes, Characidae), with keys for species from Ecuador and a discussion on the validity of the genus Knodus. Animal Biodiversity and Conservation, 36(1), 123-139. URL: http://abc.museucienciesjournals.cat/files/ABC_36-1_2013_pp_123-139.pdf
Romer, U., & Hahn, I. (2013). Apistogramma aguarico sp. n.: A new species of geophagine cichlid fish (Teleostei: Perciformes) from the Ecuadorian and Peruvian río Napo system. Vertebrate Zoology, 63(2), 171-181. URL: http://www.senckenberg.de/files/content/forschung/publikationen/vertebratezoology/vz63-2/05_vertebrate_zoology_63-2_roemer_171-181.pdf
Aguirre, W., Navarrete, R., Calle, P. & Sánchez-Garcés, G. C. (2014). First record of Iotabrycon praecox Roberts 1973 (Characidae: Stevardiinae) in the Santa Rosa Drainage, Southwestern Ecuador. Check List, 10(2), 382-385. DOI: http://dx.doi.org/10.15560/10.2.382
Arbour, J., Barriga, R., & López-Fernández, H. (2014). A New Species of Bujurquina (Teleostei: Cichlidae) from the Río Danta, Ecuador, with a Key to the Species in the Genus. Copeia, 2014(1), 79-86. DOI: http://dx.doi.org/10.1643/CI-13-028
Lujan, A., Meza-Vargas, V., Astudillo-Clavijo, V., Barriga- Salazar, R., & López-Fernández, H. (2015). A Multilocus Molecular Phylogeny for Chaetostoma Clade Genera and Species with a Review of Chaetostoma (Siluriformes: Loricariidae) from the Central Andes. Copeia, 103(3), 664-701. DOI: http://dx.doi.org/10.1643/CI-14-194
Escobar-Camacho, D., Barriga, R. & Ron, S. R. (2015) Discovering Hidden Diversity of Characins (Teleostei: Cha- raciformes) in Ecuador's Yasuní National Park. PLoS ONE, 10(8), e0135569. DOI: http://doi.org/10.1371/journal.pone.0135569
Jiménez-Prado, P., W. Aguirre, E. Laaz-Moncayo, R. Navarrete-Amaya, F. Nugra-Salazar, E. Rebolledo-Monsalve, E. Zá- rate-Hugo, A. Torres-Noboa & J. Valdiviezo-Rivera. (2015). Guía de peces para aguas continentales en la vertiente occidental del Ecuador. Esmeraldas: Pontificia Universidad Católica del Ecuador Sede Esmeraldas (PUCESE), Universidad del Azuay (UDA), Museo Ecuatoriano de Ciencias Naturales (MECN) del Instituto Nacional de Biodiversidad.
Albuja, L., Palacios, J., Cueva, M., & Paredes, G. (1996). Diagnóstico faunístico para la actualización del plan de manejo del Parque Nacional Sangay. Quito: INEFAN/GEF.
Anne, M., Gordon, G., Gallo, N., & Hall, M. (1976). Sangay Estudio de Alternativas de Manejo. Quito: Dirección General de Desarrollo Forestal-PNU/FAO.
MAG. 1982. Plan de Manejo del Parque Nacional Sangay. Quito: Ministerio de Agricultura y Ganadería, Programa Nacional Forestal, Departamento de Áreas Naturales y Vida Silvestre.
Ministerio del Ambiente del Ecuador. (2013). Sistema de Clasificación de los Ecosistemas del Ecuador Continental. Quito: Subsecretaría de Patrimoanio Natural.
Cerón, C. (2013). Herbazal lacustre montano bajo de la Cordillera Oriental de los Andes: En MAE. Sistema de Clasificación de los Ecosistemas del Ecuador Continental (pp. 128-129). Quito: Ministerio del Ambiente del Ecuador.
Granados-Lorencio, C. (1996). Ecología de Peces. Sevilla: Secretariado de Publicaciones de la Universidad de Sevilla.
Leary, S., Underwood, W., Anthony, R., Cartner, S., Corey, D., Grandin, T., Greenacre, C., Gwaltney-Brant, S., Mc- Crackin, M. A., Meyer, R., Miller, D., Shearer, J. & Yanong, R. (2013). Guidelines for the Euthanasia of Animals. Schaumburg: American Veterinary Medical Association. URL: https://www.avma.org/KB/Policies/Pages/Euthanasia-Guidelines.aspx
Maldonado-Ocampo, J.A., Ortega-Lara, A., Usma, J.S., Galvis V., G., Villa-Navarro, F.A., Vásquez G., L., Prada-Pe- dreros, S., & Ardila R., C. (2005). Peces de los Andes de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá.
Rivadeneira, J.F., Anderson, E.P., & Dávila, S. (2010). Peces de la Cuenca del Río Pastaza. Quito: Fundación Natura.
Netto-Ferreira, A. (2006). Relagöes filogenéticas dos generos de Lebiasinidae (Ostariophysi, Characiformes) (Tesis de Maestría) Universidade Federal do Rio de Janeiro, Rio de Janeiro.
Ferreira, A.L.N. (2010). Revisäo taxonómica e relagöes interespecíficas de Lebiasininae (Ostariophysi: Characiformes: Lebiasinidae) (Tésis de Doctorado). Universidade de Sao Paulo, Sao Paulo. DOI: http://doi.org/10.11606T.41.2010.tde-02022011-165808
Román-Valencia, C., Ruiz., R. & Barriga, R. (2007). Redescripción de Hemibrycon orcesi Böhlke, 1958 y H. polyodon (Gunther, 1864) (Teleostei, Characidae), incluye clave para las especies de Hemibrycon en Ecuador. Animal Biodiversity and Conservation, 30(2), 179-188. URL: http://www.raco.cat/index.php/ABC/article/view/76081/0
Géry J. (1977). Characoids of the world. New Jersey: T.F.H. Publications, Inc. Ltd.
Vari R. P. & Harold A. S. (2001). Phylogenetic study of the Neotropical fish genera Creagrutus Gunther and Piabina Reinhardt (Teleostei: Ostariophisi: Characiformes) with a revision of the cis-Andean species. Smithsonian Contribution Zoology, 613, 1-239. DOI: https://dx.doi.org/10.5479/si.00810282.613
Chernoff, B. & Machado-Allison, A. (1990). Characid fishes of the genus Ceratobranchia, with descriptions of new species from Venezuela and Perú. Proceedings of the Academy of Natural Sciences of Philadelphia, 142, 261-290. URL: http://jstor.org/stable/4064978
Schindler, D. E., & Scheuerell, M.D. (2002). Habitat coupling in lake ecosystems”. Oikos, 98, 177-189. DOI: http://dx.doi.org/10.1034/j.1600-0706.2002.980201.x
Eschmeyer, W. N., & Fong, J. D. (2016). Species by Family/Subfamily. Catalogue of Fishes. California Academy of Science. URL: http://researcharchive.calacademy.org/research/ichthyology/catalog/SpeciesByFamily.asp
Maldonado, M., Maldonado-Ocampo, J.A., Ortega, H., Encalada, A.C., Carvajal-Vallejos, F.M., Rivadeneira, J.F., Acosta, F., Jacobsen, D., Crespo, A. & Rivera-Rondón, C.A. (2011). Biodiversity in aquatic systems of the Tropical Andes. En S.K. Herzog, R. Martinez, P.M. Jorgensen, & H. Tiessen (Eds.), Climate change and biodiversity in the tropical Andes (pp. 276-294). Paris/Sâo José dos Campos: Inter-American Institute for Global Change Research (IAI) and Scientific Committee on Problems of the Environment (SCOPE). URL: http://www.iai.int/wp-content/uploads/2014/06/book.pdf
Maldonado-Ocampo J. A., Torres-Noboa, A., & Anderson, E. P. (2009). Fishes. En: C. Vriesendorp, C., Alverson, W., Moskovits, D., Stotz, D., Fuentes, S., Coronel-Tapia, B., & Anderson, E.P. (Eds), Cabeceras Cofanes- Chingual. Rapid Biological Inventories Report 21 (pp. 186-191). Chicago: Illinois The Field Museum. URL: http://fm2.fmnh.org/rbi/pdfs/RI21_Spanish.pdf
Anderson, E., & Maldonado-Ocampo, J.A. (2010). A Regional Perspective on the Diversity and Conservation of Tropical Andean Fishes. Conservation Biology, 25(1), 30-39. DOI: http://dx.doi.org/10.1111/j.1523-1739.2010.01568.x
Galvis, G., Mojica, J. I., Duque, R. S., Castellanos, C., Sánchez-Duarte, P., Arce, M., Gutiérrez, A., Jiménez, L.F., Santos, M., Vejarano-Rivadeneira, S., Arbeláez, F., Prieto, E., & Leiva, M. (2006). Peces del medio Amazonas. Región de Leticia. Serie de Guías Tropicales de Campo N 5. Bogotá: Conservación Internacional, Editprial Panamericana, Formas e Impresos.
Salcedo, N. J. (2003). Analisis filogenético del género Chaetostoma Tschudi, 1845 (Siluriformes: Loricariidae), con énfasis en especies peruanas (Tesis de Maestría). Universidad Mayor San Marcos, Lima.
Schaefer, S. A. (2003). Family Astroblepidae. En Reis, R. E., Kullander, S. O., Ferraris, C.J. Jr (Eds), Checklist of the Freshwater Fishes of South and Central America (pp. 312317). Porto Alegre: Edipucrs.
Ortega-Lara, A., Murillo, O., Pimienta, C., & Sterling, E. (2000). Los peces del alto Cauca, riqueza ictiológica del Valle del Cauca. Cali: Editorial Imagen Corporativa.
Petry, P., Bayley, P. B., & Markle, D. F. (2003). Relationships between fish assemblages, macrophytes and environmental gradients in the Amazon River floodplain. Journal of Fish Biology, 63, 547-579. DOI: http://dx.doi.org/10.1046/j.1095-8649.2003.00169.x
Soares, M., Menezes, N. A., & Junk, W. J. (2006). Adaptations of fish species to oxygen depletion in a central Amazonian floodplain lake”. Hydrobiologia, 568:353-367. DOI: http://dx.doi.org/10.1007/s10750-006-0207-z
Werner, E., & Hall, D.J. (1988). "Ontogenetic Habitat Shifts in Bluegill: The Foraging Rate-Predation Risk Tradeoff. Ecology, 69(5), 1352-1366. DOI: http://doi.org/10.2307/1941633
Lewin, W. C., Okun, N., & Mehner, T. (2004). Determinants of the distribution of juvenile fish in the littoral area of a shallow lake. Freshwater Biology, 49, 410-424. DOI: http://dx.doi.org/10.1111/j.1365-2427.2004.01193.x