



Sección B: Ciencias Biológicas y Ambientales
Listado y guía visual preliminar de macrohongos del Bosque Petrificado de Puyango-Ecuador
Preliminary list and visual guide of macrofungi of the Puyango Petrified Forest-Ecuador
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
ISSN: 1390-5384
ISSN-e: 2528-7788
Periodicidad: Bianual
vol. 15, núm. 2, 2022
Recepción: 11 Abril 2023
Aprobación: 05 Junio 2023
Autor de correspondencia: djcruz@utpl.edu.ec

Resumen: Ecuador es un país megadiverso en flora, fauna y funga, a más de ecosistemas únicos como el Bosque Petrificado de Puyango. Este bosque no ha sido investigado en cuanto a su diversidad fúngica. En el presente trabajo se registra preliminarmente por primera vez una lista y guía visual rápida de macrohongos principalmente descomponedores de madera para el Bosque Petrificado de Puyango. Los resultados sugieren una gran diversidad de hongos para este bosque, donde 28 observaciones corresponden a 28 morfoespecies. Esta información marca la línea base para futuros proyectos investigativos que permitan mostrar y valorizar la diversidad de hongos neotropicales en esta zona protegida declarada Patrimonio Nacional de Ecuador.
Palabras clave: El Oro, diversidad fúngica, Loja, hongos neotropicales.
Abstract: Ecuador is a megadiverse country in Flora, Fauna and Funga, as well as to unique ecosystems such as the Puyango Petrified Forest. This forest has not been investigated for its fungal diversity. In the present work, a preliminarily list and quick visual guide of mainly wood-decomposing macrofungi is recorded for the first time for the Puyango Petrified Forest. The results suggest a great diversity of fungi for this forest, where 28 observations correspond to 28 morphospecies. This information marks the baseline for future research projects to show and value the neotropical fungi diversity in this protected area declared National Heritage of Ecuador.
Keywords: El Oro, Fungal diversity, Loja, Neotropical fungi.
Introducción
Ecuador es uno de los países más ricos en flora, fauna y funga, por lo cual se lo considera como parte de los países megadiversos [1]. Dentro de esta diversidad de organismos, los hongos estarían en una relación de 9:1 respecto de las plantas [2]. De acuerdo con dicha estimación, Ecuador podría alojar a 144 783 especies de hongos tomando en cuenta las 16 087 plantas catalogadas y aceptadas [3].
No obstante, los estudios de inventariado y registro de diversidad de hongos en Ecuador aún son pocos [4–7] y algunos están dirigidos a fines ecológicos como diversidad de micorrizas, aplicando análisis moleculares [8–11]. Sin embargo, recientemente se ha detectado algunos avances en reporte de diversidad de hongos basados en morfología y otros estudios integrando datos moleculares [6,12–14].
Ante esta situación actual, urgen estudios que registren y valoricen este grupo de organismos reconocidos actualmente como funga [15]. La importancia de los hongos es variada, cumpliendo diferentes roles ecológicos fundamentales en la naturaleza, es decir, parásitos, saprótrofos, mutualismo o simbiosis [16]. Además, algunas especies pueden poseer potencial biotecnológico, como, por ejemplo, Agaricus subrufescens, conocido mundialmente por ser comestible, medicinal y altamente comercial [17–21].
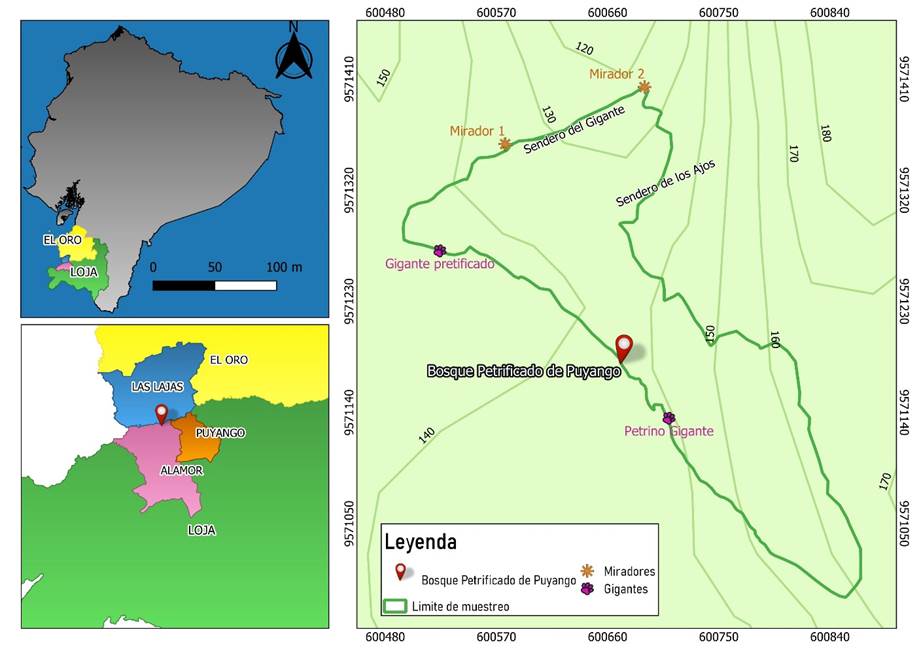
Bajo este contexto, el Bosque Petrificado de Puyango (BPP), se encuentra en la región sur de Ecuador, en el cantón Las Lajas, provincia de El Oro y cantón-parroquia Puyango-Alamor de la provincia de Loja, donde los cantones están divididos por el río Puyango, situado a 7 km de la frontera con Perú (Fig. 1). El BPP ocupa una extensión de 2569 hectáreas, de carácter montañoso, entre 360 y 500 m .s.n.m. Esta zona ecosistémica con flora y fauna principalmente transicional entre las tierras bajas del Pacífico y las elevaciones andinas es protegida y reconocida como Patrimonio Nacional de Ecuador [22], y no posee registros de especies de hongos para este ecosistema [4,13,23,24]. Este bosque se clasifica como seco tropical-natural, con remanente de vegetación endémica combinados en un ecosistema de troncos petrificados [25] enterrados por lava volcánica probablemente entre 96 a 112 millones de años durante el periodo Cretácico [22].
Por lo tanto, el objetivo de este trabajo fue realizar un registro preliminar de morfoespecies de macrohongos por primera vez para el BPP, como línea base informativa de diversidad fúngica, que permita a futuro llamar la atención de proyectos investigativos que estudien y valoricen la biodiversidad fúngica de Ecuador.
Materiales y métodos
Registro de macrohongos en el BPP
Una salida de campo casual se realizó en el mes de julio de 2021 (época húmeda culminando lluvias de invierno), con una caminata de aproximadamente 1,46 km durante tres horas revisando por fructificaciones de hongos a unos dos o tres metros a cada lado de los senderos preestablecidos dentro del BPP (Figs. 1-2A-B), además de un recorrido alrededor de zonas permitidas abiertas que contenían principalmente fragmentos de árboles petrificados asentados en el suelo (Fig. 2C-D).

Se registró fotográficamente a todos los hongos observados, tomando en cuenta una foto superior del píleo o sombreros y cuerpo fructífero completo en el caso de ascomicetos como Xylaria spp. Igualmente, se registró una foto de la parte inferior para distinguir sus estructuras como láminas, poros o denticiones del himenóforo. Adicionalmente, se anotó la información del hábito donde crecían. No se aplicaron reactivos de ninguna clase in situ, ni se colectaron dichos especímenes debido a la carencia de permiso de colección gubernamental dentro del BPP.
Determinación de morfoespecies
Las morfoespecies corresponden a una determinación preliminar basada en observación in situ de características macroscópicas de Basidiomata: colores o texturas, parte superior (píleo), parte inferior (láminas, poros, estipe), sustrato (suelo, madera, estiércol), color de Esporada (si estaba presente descargada sobre sustrato o sobre sus mismas fructificaciones) y forma de Ascomata. Los colores de cada cuerpo fructífero se basan en los códigos revisados del servidor https://encycolorpedia.es/a49074
Resultados
Registro de macrohongos del Bosque Petrificado de Puyango
Se registraron 28 taxones correspondientes a 28 morfoespecies, las mismas que se encuentran compiladas en una guía visual rápida (Figs. 3-5). Este listado preliminar de morfoespecies corresponde al primer registro de hongos para el BPP (Tabla 1):



| BASIDIOMYCOTA | ||||||
| Orden/familia | Especie | Observación | Hábito | |||
| AGARICALES | ||||||
| Agaricaceae | Agaricus cf. subrufescens Peck 1894. Ann. Rep. Reg. N.Y. St. Mus. 46: 105 (1894) [1893]. | Agaricoide solitario de estípite delgado y alargado con píleo convexo de coloración blanquecino amarillento #d8d6cf con escamas ligeramente rojizas #b5948e (Fig. 3A). | S* | |||
| Agaricus sp. | Caracterizado por su píleo convexo y láminas libres negruzcas a pardas #1c0d02 (Fig. 3B). | S* | ||||
| Psathyrellaceae | Coprinopsis cf. mexicana (Murrill) Redhead, Vilgalys y Moncalvo. en Redhead, Vilgalys, Moncalvo, Johnson y Hopple, Taxon 50(1): 229 (2001). | Característico por su crecimiento gregario, píleo ovoide de coloración rosácea ligeramente anaranjado #ffcd9d, láminas apretadas y anillo membranoso (Figs. 3C-D). | X* | |||
| Coprinopsis sp. | Crecimiento gregario, píleo cónico grisáceo #fdfdfd y láminas apretadas (Fig. 3E). | X* | ||||
| Cyphellaceae | cf. Chondrostereum sp. | Corticioide de crecimiento resupinado con basidioma efuso-reflejo pileado e himenóforo violáceo a magenta #34213b (Figs. 3F-G). | X* | |||
| Hymenogastraceae | Gymnopilus cf. peliolepis (Speg.) Singer, Lilloa 22: 561 (1951) [1949]. | Píleo convexo a plano, amarillento #b8860b con ligeras escamas, láminas cerradas y semidecurrentes y esporada ferruginosa. Anillo en el estípite no se observó (Figs. 3H-I). | X* | |||
| Pleurotaceae | Pleurotus cf. djamor (Rumph. ex Fr.) Boedijn, Rumphius Memorial 292 (1959). | Láminas decurrentes abundantes, delgadas, frágiles y blancas a ligeramente grisáceas #ffffff, con estípite lateral (Fig. 3J). | X* | |||
| Pluteaceae | Pluteus sp. | Píleo convexo y umbilicado parte central marrón oscuro #4e380b, con láminas libres de coloración ligeramente rosáceas #e6b09b (Fig. 3K). | X* | |||
| Physalacriaceae | Xerula sp. | Píleo plano con extremos ligeramente púrpura #713247, láminas distantes blanquecinas #ffffff y estípite incrustado en la materia orgánica sobre suelo (Fig. 3L). | S* | |||
| AURICULARIALES | ||||||
| Auriculariaceae | Auricularia fuscosuccinea (Mont.) Henn. ['fusco-succinea'], Bot. Jb. 17: 19 (1893). | Píleo convexo ligeramente tomentoso y de coloración rojo vino #6d174a (Fig. 3LL). | X* | |||
| GLOEOPHYLLALES | ||||||
| Gloeophyllaceae | Gloeophyllum cf. striatum (Fr.) Murrill, Bull. Torrey bot. Club 32(7): 370 (1905). | Basidioma plano ligeramente tomentoso y zonado de coloración marrón claro #836344, láminas rectas ocasionalmente bifurcadas y coloración similar al píleo (Fig. 4A). | X* | |||
| HYMENOCHAETALES | ||||||
| Hymenochaetaceae | Coltricia sp. | Basidioma centralmente estipitado, píleo circular infundiliforme ligeramente morado #b68396 y con microporos en su himenóforo (Fig. 4B). | S* | |||
| Fuscoporia ferruginosus (Schrad.) Murrill [ 'ferruginosus'], N. Amer. Fl. (New York) 9(1): 5 (1907). | Fructificación ligeramente rugosa con protuberancias de color amarillento a marrón #be7e14 (Fig. 4C). | X* | ||||
| Phellinus gilvus (Schwein.) Pat., Essai Tax. Hyménomyc. (Lons-le-Saunier): 82 (1900). | Basidioma en repisa semicircular con zonaciones y aterciopelado color marrón claro #986510, el himenóforo color marrón intenso #4e3408 (Figs. 4D-E). | X* | ||||
| Phellinus sp. | Basidioma rugoso de color amarillento a naranja #d39731 (Fig. 4F). | P* | ||||
| Hymenochaete rubiginosa (Dicks.) Lév., Annls Sci. Nat., Bot., sér. 3 5: 150 (1846). | Corticioide de crecimiento resupinado usualmente efuso-reflejo de coloración superior de amarillento a marrón claro #986510 e himenóforo color óxido #a25e2a (Figs. 4G-H). | X* | ||||
| POLYPORALES | ||||||
| Cerrenaceae | Cerrena hydnoides (Sw.) Zmitr., Mycena 1(1): 91 (2001). | Basidioma en repisa totalmente plano y pubescente, color marrón fuerte #634834 y con himenóforo poroso y ligeramente marrón #a97d5c (Figs. 4I-J). | X* | |||
| Polyporaceae | Coriolopsis rigida (Berk. & Mont.) Murrill, N. Amer. Fl. (New York) 9(2): 75 (1908). | Resupinado a efuso-reflejo, disperso y píleo de coloración amarillento a marrón claro #9c8238 y ligeramente aterciopelado a pubescente. Himenóforo con poros y coloración cremosa #ded4b5 (Figs. 4K-L). | X* | |||
| Coriolopsis sp. | Resupinado a efuso-reflejo, disperso y píleo zonificado de coloración verdoso #acd9ac. Himenóforo con poros color grisáceo #f4f4f4 (Figs. 4LL-M). | X* | ||||
| Ganoderma cf. australe (Fr.) Pat., Bull. Soc. mycol. Fr. 5(2,3): 65 (1889). | Basidioma grande superior a 30 cm de longitud coloración marrón oscuro #34060b, himenóforo de coloración blanquecina #ffffff y microporos (Fig. 4N). | X* | ||||
| Lentinus tricholoma (Mont.) Zmitr., International Journal of Medicinal Mushrooms (Redding) 12(1): 88 (2010). | Basidioma estipitado centralmente, píleo convexo a infundiliforme con vellosidades en el margen de naranja claro a márgenes más oscuros #d29a19. Himenóforo con microporos (Fig. 5A). | X* | ||||
| Neodictyopus sp. | Basidioma lateralmente estipitado y contorno sinuado, de color marrón intenso. Himenóforo con poros de color grisáceo (Figs. 5B-C). | X* | ||||
| Pseudofavolus tenuis (Fr.) G. Cunn., Bull. N.Z. Dept. Sci. Industr. Res. 164: 185 (1965). | Basidioma flabeliforme, píleo zonificado de coloración grisáceo #e7e6ea. Himenóforo con tubos hexagonales de color grisáceo oscuro #c0c0c0 (Figs. 5D-E). | X* | ||||
| Pycnoporus sanguineus (L.) Murrill, Bull. Torrey bot. Club 31(8): 421 (1904). | Basidioma en forma de repisa, de color rojo anaranjado intenso #d23102, con microporos en su himenóforo (Fig. 5F). | X* | ||||
| Fomitopsidaceae | Daedalea sp. | Basidioma en forma de repisa y escalonado, píleo de coloración cremosa #f2efed e himenóforo en forma de laberinto (Figs. 5G-H). | X* | |||
| ASCOMYCOTA | ||||||
| Familia | Especie | Observación | Hábito | |||
| XYLARIALES | ||||||
| Hypoxylaceae | Daldinia concentrica (Bolton) Ces. & De Not., Comm. Soc. crittog. Ital. 1(fasc. 4): 197 (1863). | Ascoma irregularmente esférico de color negruzco a rojizo oscuro #1c1617, internamente presenta zonas concéntricas marcadas de color grisáceo a negruzco (Fig. 5I). | X* | |||
| Xylariaceae | Xylaria sp. | Ascoma alargado filamentoso de color negro #191919 (Fig. 5J). | X* | |||
| * X = Xilófago creciendo sobre madera o troncos desconocidos en descomposición. * P = Parasítico creciendo sobre corteza de árbol aún vivo. * S = Saprótrofo sobre materia orgánica desde el suelo. | ||||||
Los órdenes Agaricales (10 morfoespecies), Polyporales (9 morfoespecies) e Hymenochaetales (5 morfoespecies), bajo esta percepción fueron los más ricos en el BPP. Los macrohongos fueron encontrados principalmente descomponiendo madera presente en árboles, ramas caídas o estacas señalizadoras de senderos, también con menor frecuencia en el suelo rico en materia orgánica, por lo que se los ha considerado mayoritariamente saprótrofos y/o xilófagos y muy escasamente terrestres. Las morfoespecies registradas fueron asignadas a diferentes epítetos y 10 morfoespecies se identificaron a nivel de género (ver Tabla 1). Todas las morfoespecies registradas para el BPP requieren ser colectadas para un futuro análisis morfológico y molecular y así corroborar esta asignación taxonómica preliminar.
Discusión
La diversidad de hongos con 28 morfoespecies que se ha registrado en este estudio preliminar es un indicativo de la riqueza de estos organismos que presenta el BPP en época húmeda. Este bosque posee varias especies endémicas de plantas [25], por lo que la composición boscosa podría estar influenciando positivamente la diversidad de hongos como se ha explicado en otros estudios [26]. De las observaciones de macrohongos, la mayoría de esta diversidad corresponde a degradadores de madera (xilófagos), que aportan servicios ambientales como la limpieza de los bosques y recambio de nutrientes por la descomposición de materia orgánica de árboles y del suelo [27].
Preliminarmente, los órdenes Agaricales, Polyporales e Hymenochaetales dentro de Basidiomycota se muestran como los más ricos en especies, a diferencia del orden Xylariales dentro de Ascomycota, del que solo se pudo encontrar dos especies. Probablemente, esta diferencia de diversidad se debe a que la observación se dio en época húmeda culminando periodos de lluvia de invierno, en los que se resaltan los organismos más perennes. También podría estar relacionado con estrategias evolutivas que presentan en Basidiomycota, diversidad de morfología en fructificaciones de mayor tamaño o esporas con respecto de Ascomycota [28]. No obstante, esta especulación debe corroborarse ejecutando un monitoreo exhaustivo entre épocas lluviosas y transición a épocas secas en el BPP.
Por otra parte, la especie A. cf. subrufescens se considera una especie importante como hongo comestible con propiedades medicinales [17,29]. En igual sentido, hongos como Pleurotus spp. pueden ser ricos en proteína [30] o especies de Polyporales como Pycnoporus sanguineus ricos en antioxidantes [31]. Asimismo, Ganoderma spp. cuenta con compuestos anticancerígenos [32] con eficiencia en el sistema inmune [17,29], siendo comercialmente cultivados en diferentes países del mundo [18–21,30-32]. Los hongos presentes en este bosque pueden ser explotados de diversas formas industrial o biotecnológicamente [33].
Este listado y guía ratifica a Ecuador como megadiverso, que requiere estudios de exploración y conocimiento de la diversidad fúngica como recursos forestales no maderables.
Conclusión
La diversidad sugiere ser rica y probablemente nueva en donde 28 observaciones corresponden a 28 morfoespecies.
Agradecimientos
Agradecemos a los colegas Dra. Lorena Riofrío, Mgtr. Carlos Naranjo y Dr. Ángel Benítez por su compañía en la visita al Bosque Petrificado de Puyango. Asimismo, agradecemos al Dr. Gerardo Robledo por sus comentarios, sugerencias y validaciones taxonómicas en el manuscrito.
Referencias
[1] Países megadiversos. (2014). Biodiversidad A-Z. Recuperado de https://www.biodiversitya-z.org/content/megadiverse-countries
[2] Hawksworth, D. L. y Lücking, R. (2017). Fungal Diversity Revisited: 2.2 to 3.8 Million Species. Microbiology spectrum, 5(4). doi: https://doi.org/10.1128/microbiolspec.FUNK-0052-2016
[3] Jørgensen, P. M. (1999). Format of the Catalogue. En P. M. Jørgensen y S. León-Yánez (Eds.), Catalogue of the vascular plants of Ecuador (pp. 41-42). Missouri Botanical Garden Press. http://www.mobot.org/MOBOT/Research/ecuador/format.shtml
[4] Læssøe, T. y Petersen, J. H. (2008). Svampelivet på ækvator (hongos de Ecuador). Svampe 58, 1-53. https://goo.gl/qskf7w
[5] Andrade, J., Malagón, O., Piepenbring, M. y Armijos, C. (2012). Etnomicología y valor nutricional de macrohongos silvestres de la comunidad indígena saraguro en el sur del Ecuador. Boletín de la Sociedad Micológica Madrid, 36, 193-202. https://bibdigital.rjb.csic.es/idurl/1/16255
[6] Cruz, D., Suárez, J. P. y Piepenbring, M. (2016). Morphological revision of Tulasnellaceae, with two new species of Tulasnella and new records of Tulasnella spp. for Ecuador. Nova Hedwigia, 102(3-4), 279-338. doi: https://doi.org/10.1127/nova_hedwigia/2015/0304
[7] Gamboa-Trujillo, P., Wartchow, F., Cerón-Martinez, C., Andi, D., Uwinjin, P., Grefa, G., Entza, M., Chimbo, E., Chimbo, J., Payaguaje, J., Piyaguaje, N., Payaguaje, D., Licuy, V., López, V., Mendua, M., Criollo, M., Jati, M., De La Cruz, S., Calazacón, M., Flores, S., Aules, E., Aigaje, C., De Aro, M., Morales, A., Murillo, Y., Farinango, G. y Gibertoni, T. (2019). Edible Mushrooms of Ecuador: consumption, myths and implications for conservation. Ethnobotany Research and Applications, 18, 1–15. https://ethnobotanyjournal.org/index.php/era/article/view/1617
[8] Liede-Schumann, S. y Breckle, S. W. (2008). Provisional checklists of flora and fauna of the San Francisco valley and its surroundings (Reserva Biológica San Francisco, Prov. Zamora-Chinchipe, Southern Ecuador). Ecotropical Monographs, 4, 256.
[9] Suárez, J. P., Weiß, M., Abele, A., Garnica, S., Oberwinkler, F. y Kottke, I. (2006). Diverse tulasnelloid fungi form mycorrhizas with epiphytic orchids in an Andean cloud forest. Mycological Research, 110(11), 1257-1270. doi: https://doi.org/10.1016/j.mycres.2006.08.004
[10] Cevallos, S., Herrera, P., Sánchez-Rodríguez, A., Declerck, S. y Suárez J. P. (2018). Untangling factors that drive community composition of root associated fungal endophytes of Neotropical epiphytic orchids. Fungal Ecology, 34, 67-75. doi: https://doi.org/10.1016/j.funeco.2018.05.002
[11] Vivanco-Galván, O., Sánchez-Rodríguez, A. y Suárez J. P. W. (2020). Wild Solanum cajanumensis species as a potential reservoir of arbuscular mycorrhizal fungi diversity compatible with cultivated Solanum betaceum species. Agriculture and Natural Resources, 54(5), 567-574. https://kasetsartjournal.ku.ac.th/abstractShow.aspx?param=YXJ0aWNsZUlEPTY1MjJ8bWVkaWFJRD02ODEx&from=4
[12] Benítez, Á., Cruz, D., Vega, M., González, L., Jaramillo, N., López, F. y Aguirre, Z. (2021). Briófitos y hongos (liquenizados y no liquenizados) del Parque Universitario Francisco Vivar Castro, Loja, Ecuador. Bosques Latitud Cero, 11(2), 1-18. doi: https://doi.org/10.54753/blc.v11i2.1102
[13] Gates, G. M., Goyes, P., Gundogdu, F., Cruz, J. y Ratkowsky, D. A. (2021). Small plot surveying reveals high fungal diversity in the Ecuadorian Amazon – a case study. Current Research in Environmental & Applied Mycology, 11(1), 16-36. https://www.researchgate.net/publication/350124266_Small_plot_surveying_reveals_high_fungal_diversity_in_the_Ecuadorian_Amazon_-a_case_study
[14] Toapanta-Alban, C. E., Ordoñez, M. E., Barnes, C. W. y Blanchette, R. A. (2021). Taxonomy of the major rhizomorphic species of the “Melanopus group” within Polyporaceae in Yasuní National Park, Ecuador. PloS One, 16(8), e0254567. doi: https://doi.org/10.1371/journal.pone.0254567
[15] Kuhar, F., Furci, G., Drechsler-Santos, E. R. y Pfister, D. H. (2018). Delimitation of Funga as a valid term for the diversity of fungal communities: The Fauna, Flora y Funga proposal (FF&F). IMA Fungus, 9(2), 71-74. doi: https://doi.org/10.1007/BF03449441
[16] Piepenbring, M., López, F. y Cáceres, O. (2016). Colaboradores escondidos – La Importancia de los Hongos en los Ecosistemas. Información para Educación Ambiental. Puente Biológico, 8, 57-91. http://www.tropica-verde.de/wp-content/uploads/2018/03/Pilze-und-ihre-Bedeutung-f%C3%BCr-das-%C3%96kosystem.pdf
[17] Hetland, G., Johnson, E., Lyberg, T. y Kvalheim, G. (2011). The Mushroom Agaricus blazei Murill Elicits Medicinal Effects on Tumor, Infection, Allergy, and Inflammation through Its Modulation of Innate Immunity and Amelioration of Th1/Th2 Imbalance and Inflammation. Advances in Pharmacological Sciences, 1-10. doi: https://doi.org/10.1155/2011/157015
[18] Wisitrassameewong, K., Karunarathna, S. C., Thongklang, N., Zhao, R., Callac, P., Moukha, S., Férandon, C., Chukeatirote, E. y Hyde, K. D. (2012). Agaricus subrufescens: A review. Saudi Journal of Biological Sciences, 19(2), 131-146. doi:https://doi.org/10.1016/J.SJBS.2012.01.003
[19] Thongklang, N., Chen, J., Bandara, A. R., Hyde, K. D., Raspé, O., Parra, L. A. y Callac, P. (2016). Studies on Agaricus subtilis, a new cultivatable species from Thailand, incidentally reveal the presence of Agaricus subrufescens in Africa. Mycoscience, 57(4), 239-250. doi: https://doi.org/10.1016/j.myc.2016.02.003
[20] Velázquez-Narváez, A. C., Medel, R., Mata, G. y Espinosa de los Monteros, A. (2018). Agaricus subrufescens en México: un recurso forestal no maderable, comestible, medicinal y potencialmente cultivable. Madera y Bosques, 24(2), 1-13. doi: https://doi.org/10.21829/myb.2018.2421574
[21] Zied, D. C., Vieira Junior, W. G., Soares, D. M. M., Stevani, C. V., Dias, E. S., Iossi, M. R. y Pardo-Giménez, A. (2021). Overview of four Agaricus subrufescens strains used in the last 15 years in Brazil and other countries and current potential materials for the future. Mycological Progress, 20(8), 953-966. doi: https://doi.org/10.1007/s11557-021-01711-x
[22] Morante-Carballo, F., Herrera-Narváez, G., Jiménez-Orellana, N. y Carrión-Mero, P. (2020). Puyango, Ecuador petrified forest, a geological heritage of the Cretaceous Albian-middle, and its relevance for the sustainable development of geotourism. Sustainability, 12(16), 6579. doi: https://doi.org/10.3390/su12166579
[23] Ordoñez, M. E. (2022, mayo 19). Fungi del Ecuador. Fungario QCAM, Pontificia Universidad Católica del Ecuador. https://bioweb.bio/fungiweb
[24] Batallas-Molina, R., Moya-Marcalla, G. F. y Navas Muñoz, D. (2021). Catálogo de hongos (Ascomycota y Basidiomycota) del Herbario Nacional del Ecuador (QCNE) del Instituto Nacional de Biodiversidad (INABIO). ACI Avances en Ciencias e Ingenierías, 12(1), 38-71. doi: https://doi.org/10.18272/aci.v12i1.1755
[25] Jumbo-Eras, E., Herrera-Feijoo, R. J., Ávila-Andrade, A., Chicaiza-Ortiz, Á., Morocho-Cuenca, M. y Chicaiza-Ortiz, C. (2021). Evaluación de la biodiversidad, amenazas y estatus de conservación de la flora y fauna del Bosque Petrificado Puyango. Green World Journal 4(2), 1-9. doi: https://doi.org/10.53313/GWJ42018
[26] Tomao, A., Bonet, J. A., Castano, C. y de-Miguel, S. (2020). How does forest management affect fungal diversity and community composition? Current knowledge and future perspectives for the conservation of forest fungi. Forest Ecology and Management 457, 117678. doi: https://doi.org/10.1016/j.foreco.2019.117678
[27] Robles, C. A., Carmarán, C. C. y Lopez, S. E. (2012). Molecular techniques based on ITS analysis: useful tools for the identification of wood-decay Basidiomycetes in urban trees? Kurtziana 37(1), 91-108. http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S1852-59622012000100009&lng=es&tlng=
[28] Oberwinkler, F. (2012). Evolutionary trends in Basidiomycota. Stapfia 96, 45-104. https://www.researchgate.net/profile/Franz-Oberwinkler/publication/230646485_Evolutionary_trends_in_Basidiomycota/links/0912f502610c7955f5000000/Evolutionary-trends-in-Basidiomycota.pdf
[29] Kerrigan, R. W. (2005). Agaricus subrufescens, a cultivated edible and medicinal mushroom, and its synonyms. Mycologia 97(1), 12-24. doi: https://doi.org/10.3852/MYCOLOGIA.97.1.12
[30] Cruz, D., Capa, D., Maza, D., Ojeda, R. y Ángel B. (2021). Producción y valor proteico de Pleurotus ostreatus en la región sur de Ecuador: Valor proteico de Pleurotus ostreatus. ACI Avances En Ciencias e Ingenierías, 12(2), 7. doi: https://doi.org/10.18272/aci.v12i2.1806
[31] Gambato, G., Todescato, K., Pavão, E. M., Scortegagna, A., Fontana, R. C., Salvador, M. y Camassola, M. (2016). Evaluation of productivity and antioxidant profile of solid-state cultivated macrofungi Pleurotus albidus and Pycnoporus sanguineus. Bioresource technology, 207, 46–51. doi: https://doi.org/10.1016/j.biortech.2016.01.121
[32] Kolniak-Ostek, J., Oszmiański, J., Szyjka, A., Moreira, H. y Barg, E. (2022). Anticancer and Antioxidant Activities in Ganoderma lucidum Wild Mushrooms in Poland, as Well as Their Phenolic and Triterpenoid Compounds. International Journal of Molecular Sciences, 23(16), 9359. MDPI AG. doi: http://dx.doi.org/10.3390/ijms23169359
[33] Hyde, K.D., Xu, J., Rapior, S. et al. (2019). The amazing potential of fungi: 50 ways we can exploit fungi industrially. Fungal Diversity 97, 1–136 doi: https://doi.org/10.1007/s13225-019-00430-9
Notas
Notas de autor
Darío Cruz tomó las fotografías de de los hongos.
djcruz@utpl.edu.ec
Información adicional
Editor:: Mateo Dávila

