Ciencias Biológicas y Ambientales
Primer registro de Ochoterenella sp. (Nematoda: Onchoceridae) en Rhinella horribilis (Anura: Bufonidae) del noroccidente de Ecuador
First record of Ochoterenella sp. (Nematoda: Onchocercidae) on Rhinella horribilis (Anura: Bufonidae) from northwestern Ecuador
Primer registro de Ochoterenella sp. (Nematoda: Onchoceridae) en Rhinella horribilis (Anura: Bufonidae) del noroccidente de Ecuador
ACI Avances en Ciencias e Ingenierías, vol. 8, 2015
Universidad San Francisco de Quito
Recepción: 04 Marzo 2016
Aprobación: 15 Noviembre 2016
Resumen: Reportamos el primer registro de parasitismo del nematodo Ochoterenella Caballero, 1944 en el sapo Rhinella horribilis. Un espécimen de Ochoterenella sp. fue encontrado en la cavidad abdominal, adherido a la pared inferior del estómago, de un R. horribilis. Los especímenes fueron colectados en Tobar Donoso, provincia de Carchi, noroccidente de Ecuador.
Palabras clave: Parasitismo, helmintos, sapo de la caña, Tobar Donoso, Bufonidae.
Abstract: We report the first record of parasitism by the nematode Ochoterenella Caballero, 1944 on the giant toad Rhinella horribilis for Ecuador. A specimen of Ochoterenella sp. was found in the abdominal cavity, adhered to the bottom wall of the stomach, of a R. horribilis. Specimens were collected at Tobar Donoso, province of Carchi, northwestern Ecuador.
Keywords: Parasitism, helminths, cane toad, Tobar Donoso, Bufonidae.
Ecuador es uno de los países del neotrópico con una alta diversidad de anfibios [1-2]. Sin embargo, la información sobre los patógenos que parasitan a este grupo de vertebrados es limitada [3-6]. Bacterias, hongos, protozoos y helmintos son los principales organismos conocidos por parasitar a diferentes especies de anfibios [6]. Por otro lado, la mayoría de estudios que abordan esta temática en Centroamérica y Sudamérica han sido desarrollados en México, Costa Rica, Guatemala, Brasil y Argentina [6-10]. Los parásitos de anfibios reconocidos en estas regiones corresponden principalmente a helmintos (p. ej., trematodos, nematodos), bacterias (p. ej., Salmonella, Leptospira), parásitos artrópodos y ectoparásitos (p. ej., Amblyomrna, Hannemania) [6-8].
Los helmintos son invertebrados caracterizados por presentar cuerpos elongados, aplanados o redondeados; su forma anatómica es reminiscente a la de un gusano. Parasitan a una gran diversidad de organismos [11] y pueden sobrevivir por largos períodos de tiempo parasitando al hospedero sin causar efectos mortales [12]. Los parásitos helmintos constituyen el grupo con mayor número de reportes en anfibios en Latinoamérica: abarcan aproximadamente 289 especies registradas en 186 hospederos [10], de los cuales 45 corresponden primordialmente a anuros que ocupan hábitats de la cuenca amazónica de Brasil, Perú y Ecuador [1-2, 10]. Los helmintos documentados para Ecuador incluyen 21 especies [3-5,10]; las ranas de los géneros Rhinella y Leptodactylus son los hospederos más frecuentes [10]. El estudio de helmintos nematodos (es decir, helmintos con cuerpos redondeados) [11] en anfibios ha reflejado una alta especialización de los parásitos a ciertas regiones anatómicas: así, los géneros Aplectana y Cylindrotaenia se especializan en parasitar los intestinos de sus hospederos [4, 13-17]; Ochoterenella, por otro lado, parasita la cavidad corporal [13, 18-24]; mientras que Rhabdias afecta particularmente a los pulmones [13, 15].
Existen algunas investigaciones sobre los nematodos que parasitan a los sapos de la familia Bufonidae [3-6, 10, 13-24]. El género de filarias Ochoterenella [25] es el grupo predominante en la infección de la cavidad corporal de esta familia de anuros (Tabla 1). Actualmente se conocen 15 especies de la familia Onchocercidae reportadas a lo largo de la región neotropical: México, Guatemala, Costa Rica, Colombia, Ecuador, Perú, Brasil, Paraguay y Jamaica [10, 26]. El género Ochoterenella está especializado en parasitar la cavidad corporal: se adhiere a las paredes del estómago y de los intestinos y causa aponeurosis muscular por el desarrollo de una membrana blanquecina que envuelve al músculo. Este tipo de filaria no ocasiona la muerte del anfibio [27]. La mayor parte de reportes de Ochoterenella han sido registrados en el huésped Rhinella marina [13, 18-24]. Sin embargo, es importante mencionar que no fue sino hasta el presente año cuando se redefinió a las poblaciones de Centroamérica y del occidente de los Andes como R. horribilis, y a las poblaciones orientales como R. marina [28]. De ese modo, la mayor parte de reportes corresponden a Ochoterenella en R. horribilis [18-24], y en menor proporción a R. marina [6, 10, 13]. En Ecuador se ha reportado la presencia de este género de nematodo en la rana lanceolada común Hypsiboas lanciformis [5]; no obstante, no se ha registrado a este parásito en otro anuro dentro del territorio ecuatoriano. En esta publicación presentamos el primer registro para Ecuador de Ochoterenella sp. parasitando al sapo Rhinella horribilis, en el noroccidente del país.
Los especímenes aquí reportados se encuentran depositados en la División de Herpetología (DHMECN) y en la Sección de Invertebrados (MECN-SIN) del Museo Ecuatoriano de Ciencias Naturales del Instituto Nacional de Biodiversidad. El espécimen de Rhinella horribilis fue preservado en etanol al 75%, y el de Ochoterenella, luego de ser extraído, fue depositado en un microtubo con etanol al 75%.
Una filaria hembra de Ochoterenella sp. (MECN-SIN-001, 20,3 mm de largo, Fig. 2-3) se encontró adherida a la pared inferior del estómago de una hembra adulta de Rhinella horribilis; se observó aponeurosis. El ejemplar de Rhinella (DHMECN 6766, 85,6 mm de longitud corporal) fue recolectado en la localidad de Tobar Donoso, a orillas del río San Juan (1.183267° N, –78.492272° W, 106 m. s. n. m.), cantón Tulcán, provincia de Carchi, durante el mes de julio del 2009. Adicionalmente, dos especímenes de R. horribilis de la misma localidad fueron examinados, pero ninguno reveló la presencia de Ochoterenella.
La determinación taxonómica como Ochoterenella sp. se consiguió a través de la identificación de las características principales del género: presencia de un par de estructuras cuticularizadas a manera de “solapas” laterales paraestomales en la región cefálica; ausencia de alae caudal y lateral; una placa cefálica más larga lateralmente que dorsoventralmente; cuatro pares de papilas, cada una compuesta por una porción basal dilatada y una distal delgada; cutícula corporal, excepto en los extremos, con bandas anulares de protuberancias pequeñas, orientadas longitudinalmente, y usualmente de apariencia bacilar; y microfilaria envainada [22, 25]. Aunque no fue posible la identificación del nematodo a nivel de especie, Ochoterenella digiticauda podría ser la más similar por el tamaño y la disposición de las protuberancias cuticulares en el cuerpo [22]. Además, es la especie reportada para Ecuador en otros anuros y en poblaciones de R. horribilis de Colombia [5, 20].
| Especie | Hospedero | Sitio de infección | Distribución | Referencia |
| Acanthocephalus correalimai | Rhinella marina | Intestino delgado | Brasil | [6] |
| Aplectana membranosa | Intestino y recto | Brasil, Ecuador y Guyana | [29] | |
| Aplectana sp. | Intestino | Brasil | [30] | |
| Aplectana vellardi | Estómago e intestino | Brasil | [31] | |
| Capillaria sp. | Cavidad corporal e intestino grueso | Brasil y Perú | [29] | |
| Catadiscus cohni | Intestino grueso | Brasil | [32] | |
| Choledocystus elegans | Vesícula biliar, intestino delgado, páncreas | Brasil | [32] | |
| Choledocystus hepaticus | R. marina o R. horribilis | Vesícula biliar | Sudamérica | [6] |
| Creptotrema lynch | R. horribilis | Intestino delgado | Colombia | [33] |
| Cylindrotaenia americana | R. marina | Intestino delgado | Brasil, Colombia, Paraguay y Perú | [13, 33] |
| Falcaustra mascula | Intestino grueso y delgado | Brasil, Argentina y Paraguay | [34, 31] | |
| Filaria sp. | Cavidad corporal | Guyana | [6] | |
| Foleyella vellardi | Cavidad corporal | Brasil | [35] | |
| Glypthelmins linguatula | Intestino delgado | Brasil | [32] | |
| Glypthelmins palmipedis | Intestino delgado y estómago | Brasil | [32, 36-37] | |
| Glypthelmins robustus | R. horribilis | Intestino delgado | Colombia | [33] |
| Glypthelmins vesicalis | R. marina | - | Brasil | [6, 36] |
| Gorgoderina cryptorchis | Vesícula biliar | Brasil | [32] | |
| Icosiella neglecta | R. marina o R. horribilis | - | Argentina y Venezuela | [38-39] |
| Lanfrediella amphicirrus | R. marina | Intestino delgado | Brasil | [40] |
| Mesocoelium incognitum | Intestino delgado | Brasil | [36] | |
| Mesocoelium monas | Intestino delgado | Brasil | [32, 37] | |
| Mesocoelium sociale | R. marina o R. horribilis | Intestino delgado | Colombia | [6] |
| Mesocoelium sp. | R. marina | Intestino delgado | Brasil y Colombia | [6, 41] |
| Mesocoelium travassosi | Intestino delgado | Brasil | [36] | |
| Mesocoelium waltoni | Intestino delgado | Brasil | [6] | |
| Microfilaria sp. | R. marina o R. horribilis | Sangre | Colombia | [6] |
| Ochoterenella albareti | R. marina | Cavidad corporal | Guyana | [6] |
| Ochoterenella caballeroi | R. horribilis | Cavidad corporal | México y Costa Rica | [18] |
| Ochoterenella chiapiensis | Cavidad corporal | México y Guatemala | [19] | |
| Ochoterenella complicata | Retroperitoneo y mesenterio | Colombia | [20] | |
| Ochoterenella convoluta | R. marina | Cavidad corporal | Brasil | [31] |
| Ochoterenella digiticauda | R. marina o R. horribilis | Cavidad corporal | México, Guatemala, Costa Rica, Colombia y Brasil | [21-23, 31, 42, 43] |
| Ochoterenella dufourae | R. marina | Cavidad corporal | Guayana | [6] |
| Ochoterenella guyanensis | Cavidad corporal | Guyana | [6] | |
| Ocholerenella oumari | Cavidad corporal | Guayana | [6] | |
| Ocholerenella royi | Cavidad corporal | Guayana | [6] | |
| Ochoterenella vellardi | Cavidad corporal | Brasil y Perú | [31] | |
| Ophiotaenia bonariensis | - | Brasil | [33] | |
| Oswaldocruzia albareti | Intestino delgado | Guyana y Ecuador | [44] | |
| Oswaldocruzia belenensis | Intestino delgado | Brasil | [45] | |
| Oswaldocruzia lopesi | Estómago e intestino | Brasil y Perú | [29] | |
| Oswaldocruzia mazzai | Intestino grueso y delgado | Guyana, Brasil y Ecuador | [14] | |
| Oswaldocruzia proencai | Intestino | Brasil y Perú | [29, 38] | |
| Oswaldocruzia sp. | Intestino | Guyana y Brasil | [29, 31] | |
| Oswaldocruzia subauricularis | Intestino | Ecuador y Brasil | [3, 35, 42] | |
| Oxyascaris similis | Intestino | Brasil | [46-47] | |
| Oxyascaris sp. | Intestino | Brasil | [30] | |
| Paraoxyascaris travassosi | Intestino delgado | Brasil | [43] | |
| Parapseudopolystoma cerrocoloradensis | R. marina o R. horribilis | Vejiga urinaria | Venezuela | [6] |
| Physaloptera sp. | R. marina | Estómago | Brasil y Perú | [29-30] |
| Plagiorchis hepaticus | - | Brasil | [36] | |
| Rhabdias fuelleborni | Pulmones | Brasil | [31] | |
| Rhabdias paraensis | Pulmones | Brasil | [48] | |
| Rhabdias sp. | Pulmones | Argentina y Brasil | [31, 37] | |
| Rhabdias sphaenocephala | Pulmones | Brasil y Perú | [31] | |
| Taenia filariformis | - | Argentina | [49] |
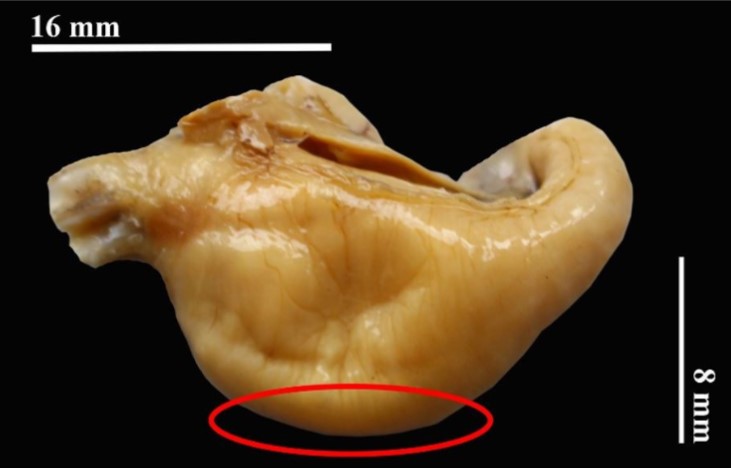
Figura 1.
Estómago extraído de Rhinella horribilis (DHMECN 6766, hembra, 85,6 mm de longitud corporal).
El ovalo rojo indica la región en la que fue encontrado el parásito Ochoterenalla sp. (MECN-SIN-001).
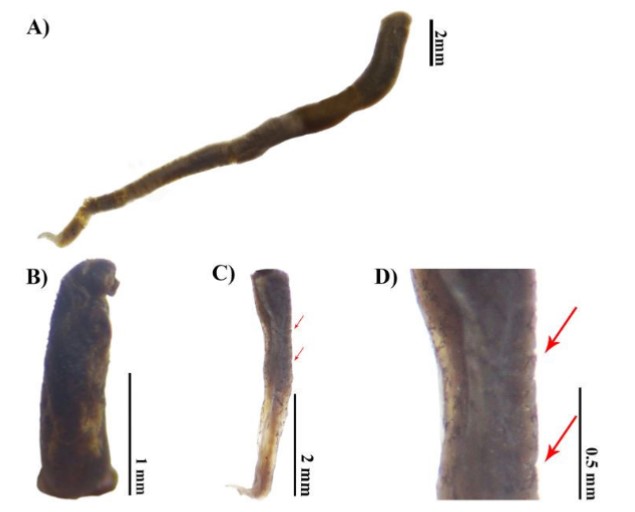
Figura 2.
Ochoterenella sp. (MECN-SIN-001) encontrado adherido a la pared inferior del estómago de un Rhinella horribilis.
A. Vista completa. B. Región cefálica. C) Región caudal. D) Detalle de bandas anulares del cuerpo.

Figura 3.
Protuberancias cuticulares características del género Ochoterenella, localizadas en la región media del cuerpo del nematodo Ochoterenella sp. (MECN-SIN-001), encontrado adherido a la pared inferior del estómago de un Rhinella horribilis.
Agradecimientos
Dejamos constancia de nuestro agradecimiento a los colectores del ejemplar de Rhinella: Mario Yánez-Muñoz, Santiago Villamarín y Marco Altamirano; al Ministerio del Ambiente, por otorgar el permiso de investigación N.° 001-IC-FAU/DPS/MA; y a Santiago Villamarín por prestar todas las facilidades en la Sección de Invertebrados del MECN-SIN.
Referencias bibliográficas
[1] Ron, S. R., Guayasamín, J. M., Yánez-Muñoz, M. H., Merino-Viteri, A., Ortiz, D. A., & Nicolalde, D. A. (2016). “AmphibiaWebEcuador”. Versión 2016.0. Museo de Zoología, Pontificia Universidad Católica del Ecuador. URL: http://zoologia.puce.edu.ec/Vertebrados/anfibios.
[2] Frost, D. R. (2015). Amphibian Species of the World: an Online Reference. Versión 6.0. American Museum of Natural History.URL: http://research.amnh.org/herpetology/amphibia/index.html
[3] Ben Slimane, B., & Durette-Desset, C. (1995). Oswaldocruzia (Nematoda, Trichostrongylina, Molineoidea) parasites d’Amphibiens du Bresil et de l’Equateur, avec redefinition de l’espece-type O. subauricularis (Rudolphi, 1819) et d’ O. mazzai Travassos, 1935. Revue Suisse de Zoologie, 102 (3), 635-653.
[4] McAllister, C. T., Bursey, C. R., & Freed, P. S. (2010). Helminth parasites of selected amphibians and reptiles from the Republic of Ecuador. Comparative Parasitology, 77 (1), 52-66.
[5] Dyer, W. G., & Altig, R. (1977). Helminths of some ecuadorian anurans. Herpetologica, 33 (3), 293-296.
[6] Speare, R. (1990). A review of the diseases of the cane toad, Bufo marinus, with comments on biological control. Wildlife Research, 17, 387-410.
[7] Hamann, M. I., Kehr, A. I., & González, C. E. (2012). Community Structure of Helminth Parasites of Leptodactylus bufonius (Anura: Leptodactylidae) from Northeastern Argentina. Zoological Studies, 51 (8), 1454-1463.
[8] Brus, A. W. (2012). A new species of frog (Strabomantidae: Pristimantis) from Peru with comments on its ectoparasites (Acari: Trombiculidae). Honor Projects. Paper 49.
[9] Cabrera-Guzmán, E. León-Régagnon, V., & García-Prieto, L. (2007). Helminth Parasites of the Leopard Frog Rana cf. forreri (Amphibia: Ranidae) in Acapulco, Guerrero, Mexico. Comp. Parasitol. 74 (1), 96-107.
[10] Magalhães Campião, K., Honorio Morais, D., Tavares Dias, O., Aguiar, A., De Melo Toledo, G., Roland Tavares, L. E., & Da Silva., R. J. (2014). Checklist of Helminth parasites of Amphibians from South America. Zootaxa. 3843, 93. DOI: http://dx.doi.org/10.11646/zootaxa.3843.1.1
[11] Castro, G. A. (1996). Helminths: Structure, Classification, Growth, and Development. En: Baron S., editor. Medical Microbiology. 4th edition. Galveston (TX): University of Texas Medical Branch at Galveston, Chapter 86. Available from: http://www.ncbi.nlm.nih.gov/books/NBK8282
[12] Elliott, A. M., Kizza, M., Quigley, M. A., Ndibazza, J., Nampijja, M., Muhangi, L., & Whitworth, J. A. (2007). The impact of helminths on the response to immunization and on the incidence of infection and disease in childhood in Uganda: design of a randomized, double blind, placebo-controlled, factorial trial of deworming interventions delivered in pregnancy and early childhood. Clinical Trials, 4 (1), 42–57. DOI: http://doi.org/10.1177/1740774506075248
[13] Chero, J., Cruces, C., Iannacone, J., Sáez, G., Alvariño, L., Guabloche, A., Romero, S., Tuesta, E., Morales, V., & Da Silva, R. J. (2015). Índices ecológicos de los helmintos parásitos del sapo andino Rhinella Poeppigii (Tschudi, 1845) (Anura: Bufonidae) del Perú. The Biologist, 13 (1), 111-124.
[14] McAllister, C. T., Bursey, C. R., & Freed, P. S. (2010). Helminth parasites of amphibians and reptiles from the Ucayali Region, Peru. Journal of Parasitology, 96 (2), 444-447.
[15] Iannacone, J. (2003). Helmintos parásitos de Atelopus bomolochus Peters, 1973 (Anura: Bufonidae) de Piura, Perú. Gayana, 67(1), 9-15.
[16] Dyer, W. G. (1986). Cestodes of some Ecuadorian amphibians and reptiles. Proceedings of the Helminthological Society of Washington, 53, 182-183.
[17] Bursey C. R., Goldberg, S. R. & Parmelee, J. R. (2001). Gastrointestinal helminths of 51 species of anurans from Reserva Cuzco Amazónico, Perú. Comparative Parasitology, 68 (1), 21-35.
[18] Esslinger, J. H. (1987). Ochoterenella caballeroi sp. n. and O. nanolarvata sp. n. (Nematoda: Filarioidea) from the Toad Bufo marinus. Proc. Helminthol. Soc. Wash., 54 (1), 126-132.
[19] Esslinger, J. H. (1988). Ochoterenella chiapensis n. sp. (Nematoda: Filarioidea) from the toad Bufo marinus in Mexico and Guatemala. Trans. Am. Microsc. Soc., 107, 203-208.
[20] Esslinger, J. H. (1989). Ochoterenella complicata n. sp. (Nematoda: Filarioidea) from the toad Bufo marinus in Western Colombia. Trans. Am. Microsc. Soc., 108, 197-203.
[21] Marinkelle, C. J. (1970). Observaciones sobre la periodicidad de las microfilarias de Ochoterenella en Bufo marinus de Colombia. Revista Biología Tropical, 16 (2), 145-152.
[22] Esslinger, J. H. (1986). Redescription of Ochoterenella digiticauda Caballero, 1944 (Nematoda: Filarioidea) from the Toad, Bufo marinus, with a Redefinition of the Genus Ochoterenella Caballero, 1944. Proc. Helminthol. Soc. Wash., 53 (2), 210-217.
[23] Goldberg, S. R., & Bursey, C. R. (2008). Helminths from fifteen species of frogs (Anura, Hylidae) from Costa Rica. Phyllomedusa, 7(1), 25-33.
[24] Esslinger, J. H. 1988. Ochoterenella figueroai sp. n. and O. lamothei sp. n. (Nematoda: Filarioidea) from the Toad Bufo marinus. Proc. Helminthol. Soc. Wash., 55 (2), 146-154.
[25] Caballero, E. (1944). Estudios helmintológicos de la región oncocercosa de México y de la República de Guatemala. Nematoda: 1.a parte. Filarioidea I. Anales del Instituto de Biología-México, 15, 87-108.
[26] Toledo, G. M., Fiorillo, B. F., Silva, R. J., Anjos, L. A., & Prado, C. P. A. (2013). Occurrence of Ochoterenella digiticauda (Nematoda: Onchocercidae) infecting the gladiator frog Hypsiboas lundii (Anura: Hylidae) in Brazil. Herpetology Notes, 6, 74-50.
[27] Guillén-Hernández, S. (1992). Comunidades de los helmintos de algunos anuros de “Los Tuxtlas”, Veracruz. Tesis de Maestría, Facultad de Ciencias, Universidad Nacional Autónoma de México, D. F. 90 pp.
[28] Acevedo, A. A., Lampo, M., & Cipriani, R. (2016).The cane or marine toad, Rhinella marina (Anura, Bufonidae): two genetically and morphologically distinct species. Zootaxa, 4103 (6), 574-586.
[29] Gonçalves, A. Q., Vicente, J. J., & Pinto, R. M. (2002) Nematodes of amazonian vertebrates deposited in the helminthological collection of the Oswaldo Cruz Institute with new records. Revista Brasileira de Zoologia, 19, 453–465. DOI: http://dx.doi.org/10.1590/s0101-81752002000200011
[30] Travassos, L., & Freitas, J. F. T. (1964). Pesquisas helmintológicas realizadas em Maicujú, Estado do Pará. Publicações Avulsas do Museu Paraense Emílio Goeldi, 1, 3-16.
[31] Vicente J. J., Rodrigues, H. O., Gomes, D. C. & Pinto, R. M. (1991). Nematóides do Brasil 2.a parte: Nematóides de anfíbios. Revista Brasileira de Zoologia, 7, 549-626. DOI: http://dx.doi.org/10.1590/s0101-81751990000400015
[32] Travassos, L., Freitas, J. F. T. & Kohn, A. (1969). Trematódeos do Brasil. Memórias do Instituto Oswaldo Cruz, 67, 1-886.
[33] Brooks, D. R. (1976). Five species of Platyhelminths from Bufo marinus L. (Anura: Bufonidae) in Colombia with descriptions of Creptotrema lynchi sp. n. (Digenea: Allocreadiidae) and Glypthelmins robustus sp. n. (Digenea: Macroderoididae). Journal of Parasitology, 62 (3), 429-433. DOI: http://dx.doi.org/10.2307/3279153
[34] Travassos, L. (1932). Nota sobre Strongyloides. Anais da Academia Brasileira de Ciências, 4, 39-40.
[35] Walton, A.C. (1935). The nematoda as parasites of Amphibia II. Journal of Parasitology, 21 (1), 27-50. DOI: http://dx.doi.org/10.2307/3271792
[36] Yamaguti, S. (1958). Systema Helminthum-The digenetic trematodes of vertebrates. Vol. 1. Part I and II. Londres: Interscience Publishers.
[37] Rodrigues, H. O., Rodrigues, S. S. & Faria, Z. (1990). Contribution to the knowledge of the helminthological fauna of vertebrates of Maricá, Rio de Janeiro state, Brazil. Memórias do Instituto Oswaldo Cruz, 85, 115-116. DOI: http://dx.doi.org/10.1590/s0074-02761990000100020
[38] Baker, M. R. & Vaucher, C. (1986). Parasitic helminths from Paraguay XII: Aplectana Raillet and Henry, 1916 (Nematoda: Cosmocercoidea) from frogs. Revue Suisse Zoologie, 93, 607-616.
[39] Guerrero, R. (1971). Helmintos de la Hacienda “El Limón”, D. F., Venezuela. Nematodes de vertebrados I. Memoria Sociedad de Ciencias Naturales La Salle, 31, 175-230.
[40] Melo, F. T., Giese, E. G., Furtado, A. P., Soares, M. J., Gonçalves, E. C., Vallinoto, A. C. R. & Santos, J. N. (2011). Lanfrediella amphicirrus n. gen. n. sp. Nematotaeniidae (Cestoda: Cyclophylidea), a tapeworm parasite of Rhinella marina (Linnaeus, 1758) (Amphibia: Bufonidade). Memórias do lnstituto Oswaldo Cruz, 106, 670-677. DOI: http://dx.doi.org/10.1590/s0074-02762011000600005
[41] Perez, M. D. (1964). Trematódeos digenéticos parasitos de Anura (Amphibia) da América do Sul. Tese de Livre Docência. Faculdade de Farmácia e Bioquímica, Universidade de São Paulo, São Paulo, Brasil. 152 pp.
[42] Yamaguti, S. (1961). Systema Helminthum-Nematodes. Vol. III. Part I e II. Londres: Interscience Publishers.
[43] Rodrigues, H. O., Rodrigues, S. S. & Cristofaro, R. (1982). Contribuição ao conhecimento da fauna helmintológica de Barra do Piraí, estado do Rio de Janeiro. Atas da Sociedade de Biologia do Rio de Janeiro, 23, 5-8.
[44] Ben Slimane, B. B. & Durette-Desset, M. C. (1996). Four new species of Oswaldocruzia (Nematoda: Trichostrongylina, Molineoidea) parasitizing Amphibians and Lizards from Ecuador. Memórias do Instituto Oswaldo Cruz, 91 (3), 317-328. DOI: http://dx.doi.org/10.1590/s0074-02761996000300012
[45] Santos, J. N., Giese, E. G., Maldonado Jr., A. & Lanfredi, R. M. (2008). A new species of Oswaldocruzia (Molineidae: Nematoda) in Chaunus marinus (Amphibian: Bufonidae) (Linneaus, 1758) from Brazil. Journal of Parasitology, 94, 264–268. DOI: http://dx.doi.org/10.1645/ge-1336.1
[46] Travassos, L. (1925). Contribuições para o conhecimento da fauna helmintológica dos batráchios do Brasil. Nematódeos intestinais. Sciencia Medica, 3 (1), 673-687.
[47] Freitas, J. F. T. (1958). Breve nota sobre alguns nematódeos de répteis e anfíbios. Atas da Sociedade de Biologia do Rio de Janeiro, 35-38.
[48] Santos, J. N., Melo, F. T. V., Nascimento, L. C. S., Nascimento, D. E. B., Giese, E. G. & Furtado, A. P. (2011). Rhabdias paraensis sp. nov: a parasite of the lungs of Rhinella marina (Amphibia: Bufonidae) from Brazilian Amazonia. Memórias do Instituto Oswaldo Cruz, 106 (4), 433-440. DOI: http://dx.doi.org/10.1590/s0074-02762011000400008
[49] Yamaguti, S. (1959) Systema Helminthum-Cestodes. Vol. II. Londres: Interscience Publishers.
Notas de autor
carolina.reyes@ambiente.gob.ec
Información adicional
permiso de investigación: N.° 001-IC-FAU/DPS/MA