Análisis microbiológico de preparados en polvo para lactantes comercializados en Quito, Ecuador
Microbiological quality of powdered infant formula sold in Quito, Ecuador
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
Recepción: 07 Mayo 2021
Aprobación: 16 Noviembre 2021
Resumen: La leche materna es el alimento más completo para los lactantes. Sin embargo, cuando no es posible la lactancia materna, los preparados comerciales en polvo son utilizados como sustitutos. Estas fórmulas están diseñadas para proveer de nutrientes suficientes, garantizando el óptimo crecimiento de los niños, pero al no ser estériles podrían ser portadoras de microorganismos que afecten a este grupo susceptible. El objetivo de este estudio fue determinar la calidad microbiológica de muestras de productos para consumo local. Para esto, un total de 24 preparados lácteos (12 de inicio y 12 de continuación) fueron adquiridos en tiendas y supermercados en Quito en el año 2019. Se utilizaron métodos de cultivo convencionales para determinar la cantidad de aerobios totales y de enterobacterias, y para identificar los microorganismos presentes. De acuerdo con los criterios microbiológicos especificados en las normas ecuatorianas del Instituto Nacional de Normalización, todos los preparados de inicio cumplieron con los criterios microbiológicos, tanto para aerobios como para enterobacterias. Mientras que, el 50% de preparados infantiles de continuación sobrepasaron los valores establecidos en la norma tanto para aerobios como para enterobacterias. Salmonella spp. ni Staphylococcus aureus fueron aislados en ninguna muestra. Los patógenos de transmisión alimentaria identificados en los preparados de continuación fueron Bacillus cereus (25%) y Hafnia alvei (16,7%). Escherichia coli, un indicador de contaminación fecal, estuvo presente en el 8,3% de las muestras de continuación. Otras enterobacterias en las fórmulas de continuación fueron Klebsiella oxytoca y Enterobacter aerogenes (25% cada uno) y Pantoea agglomerans (8,3%). En los preparados de inicio se aislaron Klebsiella oxytoca (41,7%), Pantoea agglomerans y Citrobacter freundii (25% cada uno). Bacillus subtilis como una bacteria asociada con la falta de cumplimiento de Buenas Prácticas de Manufactura se encontró en preparados tanto de inicio como de continuación en el 16,7% y 75%, respectivamente. Pseudomonas sp. se encontró en el 8,3% de las muestras de inicio. Los resultados indican la necesidad de reforzar el control de calidad y la aplicación de las Buenas Prácticas de Manufactura de los preparados infantiles que se elaboran en el país, en especial de los de continuación, dado que, en algunos de ellos, microorganismos patógenos fueron aislados, constituyendo un riesgo potencial de infección para los infantes.
Palabras clave: preparados infantiles en polvo, leche de fórmula, calidad microbiológica, enfermedades transmitidas por alimentos, patógenos de transmisión alimentaria.
Abstract: Human milk is recognized as the best form of nutrition for infants. However, where breastfeeding is not possible, infant milk formulas are used as breast milk substitutes. These formulas provide infants essential nutrients for their normal growth and development, but pathogenic microbes responsible for serious illness could contaminate them. The purpose of this study was to investigate the microbial quality of powdered formulas sold in Quito. A total of 12 powdered infant formulas and 12 powdered follow-up formulas were collected from markets in Quito in 2019. Microbiological quality of samples was analyzed using conventional culture methods. According to the microbiological criteria specified in the Ecuadorian regulation, all powdered infant formulas complied with the total count of aerobic mesophilic organisms and enterobacteria. However, six powered follow-up samples failed to comply with the regulation. Salmonella spp. and Staphylococcus aureus were not found in any sample. The isolated foodborne pathogens in the follow-up formulas were Bacillus cereus (25%) and Hafnia alvei (16,7%). Escherichia coli, a fecal-indicator organism was present in 8,3% of follow-up samples. The follow-up formulas were also contaminated by other enterobacteria like Klebsiella oxytoca and Enterobacter aerogenes (25% each) and Pantoea agglomerans (8,3%). The enterobacteria found in powdered infant formulas were Klebsiella oxytoca (41,7%), Pantoea agglomerans and Citrobacter freundii (25% each). Bacteria associated with nonadherence to Good Manufacturing Practices were Bacillus subtilis isolated in infant and follow-up formulas 16,7% and 75%, respectively and Pseudomonas sp. in 8,3% of infant milk. This study indicates the necessity of conducing further microbial contamination research in powdered formula products because they could be a potential source of food contaminants and a risk for infants and babies.
Keywords: powdered milk formula, follow-up formula, foodborne infections, foodborne pathogens.
INTRODUCCIÓN
La alimentación con leche materna es ideal para el crecimiento y desarrollo adecuado de lactantes y niños pequeños. Se ha reportado que provee muchos beneficios a nivel cognoscitivo, sensorial y de protección contra enfermedades infecciosas [1]. La Organización Mundial de la Salud recomienda que sea exclusiva durante los 6 primeros meses de vida y que se continúe hasta los dos años o más [2]. Sin embargo, esta práctica milenaria es cada vez menos frecuente, ya sea por enfermedad de la madre, por la creciente participación de las mujeres en diversas áreas laborales, las pocas facilidades para dar de lactar en áreas públicas o los anuncios comerciales que presentan a los preparados en polvo como alimentos completos que pueden sustituir a la leche materna [3,4]. El Instituto Nacional de Estadísticas y Censos del Ecuador, analizó la prevalencia de la lactancia materna exclusiva en niños ecuatorianos menores de 2 años, indicando que el 72,7% recibieron leche materna en la primera hora de vida y que mientras aumenta el nivel de instrucción de la madre, el porcentaje de lactancia materna exclusiva disminuye [5].
Existen en el mercado varios tipos de preparados en polvo de origen lácteo y no lácteo, formulados para cubrir las necesidades nutricionales de lactantes en etapas críticas de crecimiento y desarrollo [6]. Según el grupo al que van dirigidos pueden ser de inicio, para lactantes de 0 a seis meses, o de continuación para niños de seis a 12 meses y se diferencian por su composición nutricional [7,8]. Estos productos se elaboran mediante procesos de mezcla de varios ingredientes como: leche en polvo, concentrados de proteína de soja, hidratos de carbono, grasas, vitaminas, minerales y algunos aditivos alimentarios según los lineamientos establecidos en el Código de Prácticas de Higiene para Alimentos con Bajo contenido de Humedad CXC 75-2015 [9]. Todos los ingredientes deben estar limpios, ser de buena calidad e inocuos [10]. En su proceso de elaboración es necesario que se cumpla rigurosamente las buenas prácticas de higiene para garantizar la inocuidad del producto [11], y deberán ajustarse a los criterios microbiológicos relativos a los alimentos.
La contaminación microbiana de estos preparados puede ser causa de infecciones y enfermedades en lactantes y niños pequeños, resultando en graves secuelas en su desarrollo e incluso la muerte [12]. Por ejemplo, en España en 2008, se determinó que leche de fórmula contaminada con Salmonella serotipo Kedougou, provocó diarrea y fiebre en 31 niños menores a un año, 10 de ellos necesitaron hospitalización [13]. Cronobacter sakazakii también ha sido implicado en brotes, como el caso de Bélgica, donde preparados infantiles utilizados en la unidad de cuidados intensivos neonatales de un hospital, estaban contaminados con este microorganismo provocando que 12 neonatos desarrollen colitis necrotizante, de los cuales dos de ellos fallecieron [14].
En el Ecuador, la Agencia Nacional de Regulación, Control y Vigilancia Sanitaria (ARCSA), es la entidad reguladora encargada del control post registro de muchos productos, entre ellos, los preparados infantiles en polvo. El control se hace a través de un análisis microbiológico, donde se comprueba la calidad y seguridad de los productos importados y/o cuando se hayan presentado alertas sanitarias por contaminación microbiana [15].
En el año 2017, en base al informe presentado por la Red Internacional de Autoridades de Seguridad Alimentaria (INFOSAN, por sus siglas en inglés), la ARCSA, puso en alerta a los establecimientos encargados de la importación y comercialización de preparados infantiles en polvo debido a la contaminación con Salmonella de marcas francesas comercializadas en Perú y Colombia, las cuales fueron retiradas del mercado [16]. En el año 2019, una nueva alerta por la contaminación de productos infantiles con Salmonella, ahora de una marca que se importaba y comercializaba en farmacias y supermercados de Ecuador, condujo a un retiro del producto en el mercado por el alto riesgo que supone la presencia de este patógeno [17].
Debido a estas alertas sanitarias y a la escasa investigación sobre la inocuidad de estos productos en el país, este estudio tuvo por objetivo el análisis de muestras de preparados infantiles comercializados en la ciudad de Quito, en base al cumplimiento de los criterios microbiológicos descritos en las normas del Instituto Ecuatoriano de Normalización (INEN), NTE INEN 707 (2013) para preparados de inicio (para lactantes de 0 a seis meses) y NTE INEN 2516 (2010) para preparados de continuación (para lactantes de seis a 12 meses) [18, 19]. Los análisis realizados en las muestras fueron el contaje de microorganismos aerobios y de enterobacterias. También se investigó la presencia de bacterias responsables de enfermedades transmitidas por alimentos (ETA) como Salmonella, Staphylococcus aureus, Bacillus cereus y Hafnia alvei. Se analizaron las muestras para buscar la presencia de indicadores de calidad como Escherichia coli y de otros microorganismos que pudieran indicar falta de aplicación de Buenas Prácticas de Manufactura (BPM), higiene deficiente o un inadecuado tratamiento térmico. Los datos generados son de utilidad para determinar la inocuidad y calidad microbiológica de estos productos destinados a un grupo poblacional sensible.
MATERIALES Y MÉTODOS
Diseño del estudio y muestra
Este fue un estudio observacional, descriptivo y transversal. De acuerdo con la división geográfica de la ciudad se seleccionaron de forma no aleatoria supermercados, tiendas y farmacias del norte, centro y sur de Quito, donde se adquirieron los productos a disponibilidad de los establecimientos comerciales. En total se obtuvieron 24 preparados infantiles en polvo de 8 diferentes marcas: 12 preparados de inicio (para lactantes de 0 a seis meses) todos importados y 12 preparados de continuación (para niños de seis a 12 meses) de los cuales 3 fueron importados y 9 de fabricación local. El precio en el mercado estaba en un rango de US$ 4 a 25. El periodo de ejecución del estudio fue del 11 de marzo al 5 de septiembre de 2019.
Las muestras adquiridas contaban con registro o notificación sanitaria, estaban dentro del periodo de vida útil y sus envases primarios no presentaban irregularidades ni alteraciones. Fueron transportadas al laboratorio de Microbiología General y Farmacéutica de la Facultad de Ciencias Químicas de la Universidad Central del Ecuador, donde se procesaron en un máximo de cuatro horas después de haber sido adquiridas.
Contaje de microorganismos en los preparados infantiles en polvo
Se siguió la metodología descrita en la norma AOAC 990.12 (2002) para el contaje de microorganismos aerobios [20]. Brevemente, se tomaron 10 gramos de cada producto y se disolvieron en 90 ml de diluyente tamponado de fosfato de Butterfield estéril a pH 7,2 (dilución 10-1); para las diluciones 10- 2 y 10- 3, se tomaron 10 ml de la dilución anterior y se colocaron en 90 ml del diluyente estéril. Se inoculó 1 ml de cada dilución en placas Petrifilm (por duplicado) para recuento de aerobios y se dejaron reposar por 3 minutos a temperatura ambiente, antes de ser incubadas a 37 °C en una incubadora Incucell de MMM durante 48 horas. Para el recuento de enterobacterias se siguió la metodología descrita en la norma AOAC 2003.01 (2006), donde las placas Petrifilm para enterobacterias fueron inoculadas con las diluciones y se incubaron durante 24 horas a 37 °C [21]. El procesamiento de las muestras se llevó a cabo en una cabina de bioseguridad. Después del tiempo de incubación, se cuantificaron las colonias para el cálculo de unidades formadoras de colonia por gramo de muestra (UFC/g) [22].
Aislamiento e identificación de microorganismos
Diluciones de las muestras se sembraron en agar Manitol-Yema de Huevo-Polimixina para la identificación de especies de Bacillus, en Manitol Salado para especies de Staphylococcus y en agar Cetrimida para Pseudomonas spp. La confirmación de géneros y especies se hizo a través de pruebas bioquímicas específicas, según el tipo de microorganismo aislado en caja [23-25]. Todos los medios de cultivo utilizados en este estudio fueron de BD, Maryland, Estados Unidos.
Para Salmonella, se siguió la metodología de la norma ISO 6579-1: (2017), para el pre enriquecimiento se disolvieron 25 gramos de muestra en 225 ml de agua peptonada tamponada y se incubó de 16 a 20 horas a 37 °C. Se inoculó 1 ml de muestra preenriquecida en 10 ml de caldo Rappaport Vassiliadis y se incubó a 42 °C durante 24 horas. Después del tiempo de incubación, las muestras que presentaron turbidez o cambio de coloración del medio se sembraron por estriación en agar Xilosa Lisina Desoxicolato (XLD) que se incubó durante 24 horas a 37 °C. Colonias características, se aislaron en agar Tripticasa Soya (TSA) y se realizaron las pruebas bioquímicas en los medios: Triple Azúcar Hierro Agar (TSI), Lisina Hierro Agar (LIA), Urea, y Motilidad Indol Ornitina Agar (MIO) [26].
Para identificar las enterobacterias presentes en las muestras, se hizo un enriquecimiento selectivo, para lo cual se siguió la metodología de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés). Se incorporaron 10 g de muestra en 90 ml de agua peptonada tamponada y se incubó durante 24 horas a 37 °C. Un mililitro se colocó en 9 ml de caldo de Enriquecimiento de Enterobacterias (EE) de Mossel y se incubó a 37 °C durante 24 horas. Después del tiempo de incubación, las muestras que presentaron turbidez o cambio de coloración del medio se sembraron por duplicado en agar Violeta Rojo Bilis Glucosa (VRBG) y se incubaron durante 24 horas a 37 °C. Las colonias características, se aislaron en agar TSA y se realizaron las pruebas bioquímicas correspondientes [27].
Identificación de especies de enterobacterias con el Kit Microgen GN-ID A
Según la metodología descrita por Microgen Bioproducts Ltd (2007), se suspendió una colonia de un bacilo Gram negativo/oxidasa negativo de un cultivo de TSA de 24 horas, en 3 ml de solución salina estéril al 0,9%. Se inoculó cada pocillo del kit con 100 uL de la suspensión bacteriana y se incubó por 24 horas a 37 °C. Después del tiempo de incubación, se realizó la lectura e interpretación de los resultados. En la base de datos del programa Microgen ID Software Registration, se ingresó la asignación numérica, para obtener el género y especie del microorganismo ensayado [28].
Criterios microbiológicos según las normas vigentes
Acorde con la norma técnica ecuatoriana INEN 707 (2013), los preparados infantiles de inicio pueden tener contajes iguales o menores a 500 UFC/g para microorganismos aerobios y ausencia de enterobacterias en 10 gramos de muestra. Para los preparados de continuación los valores de microorganismos aerobios deben ser iguales o menores a 10. UFC/g y ausencia en 10 gramos para enterobacterias según la norma técnica ecuatoriana INEN 2516 (2010). En este estudio no se consideró el valor de < 3 para enterobacterias de la norma, sino ausencia en 10 gramos al igual que en la INEN 707, debido a que es coherente con el método analítico empleado. Ninguno de los preparados tanto de inicio como de continuación debe tener Salmonella spp. en 25 gramos, ni Cronobacter sakazakii en 10 gramos [18, 19]. Dado que se analizó una muestra de cada lote y marca, se tomó en cuenta el valor de m de los requisitos microbiológicos de las normas y no el de M, debido al n menor. Siendo n el número de muestras a analizar por lote, m el valor que separa la calidad microbiológica buena de la marginal y M el valor de recuento microbiano por encima del cual las muestras son inaceptables.
Análisis de datos
El análisis de este estudio fue descriptivo. Los contajes de microorganismos fueron comparados con las normas INEN 707 (2013) e INEN 2516 (2010) para saber qué productos cumplían o no con los parámetros establecidos en las mismas [18, 19]. Los porcentajes de muestras con presencia de un determinado microorganismo, fueron obtenidos relacionando el número de muestras donde hubo el aislamiento, sobre el total de muestras analizadas.
RESULTADOS
Todos los preparados de inicio analizados fueron importados y el 100% cumplieron con el recuento de microorganismos aerobios, al presentar valores menores a 500 UFC/g y al no contener enterobacterias en 10 gramos de producto analizado. De los 12 preparados de continuación, 3 eran importados y cumplieron los valores tanto para aerobios (<10. UFC/g) como para enterobacterias (ausencia/10g). De los 9 productos restantes, de fabricación nacional, 6 no cumplieron, ya que presentaron valores de aerobios de entre 1,2 x 10. y 2,8 x 10. UFC/g y valores de entre 2 x 10. y 1,2 x10. UFC/g para enterobacterias (Tabla 1). No hubo presencia de Salmonella spp. ni Staphylococcus aureus en ninguno de los preparados analizados. Sin embargo, patógenos de alimentos como Bacillus cereus se aisló en el 25% y Hafnia alvei en el 16,7% de preparados de continuación.
La determinación de enterobacterias como indicadores de prácticas de higiene, mostró en los productos de inicio a Klebsiella oxytoca (41,7%), seguida de Pantoea agglomerans y Citrobacter freundii en igual porcentaje (25%). En el caso de las fórmulas de continuación se aisló Klebsiella oxytoca y Enterobacter aerogenes (cada una en un 25%) y Escherichia coli al igual que Pantoea agglomerans en el 8,3% de muestras (Fig. 1).
Otros microorganismos que pueden estar relacionados con fallas en los procesos de elaboración y almacenamiento también se identificaron, Bacillus subtilis se aisló en el 16,7% de fórmulas de inicio y en el 75% de continuación. Pseudomonas sp. se identificó solamente en los preparados de inicio en un 8,3% (Fig. 1).
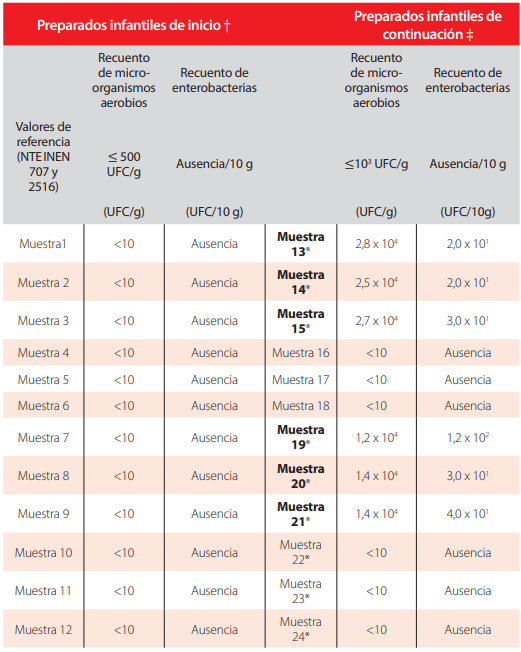
Recuento de microorganismos aerobios y de enterobacterias en los preparados infantiles analizados (Los autores)
En negrita se detallan las muestras que incumplieron el recuento de aerobios y el de enterobacterias. * Muestras que fueron de fabricación local. † norma INEN 707. ‡ norma INEN 2516.
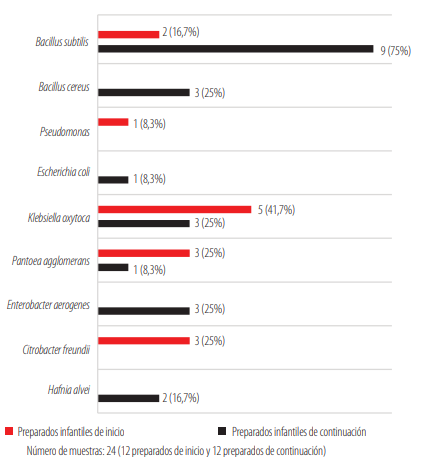
FIGURA 1.
Especies de microorganismos identificados en los preparados infantiles analizados (Los autores)
DISCUSIÓN
Los preparados infantiles en polvo son alimentos procesados empleados con frecuencia en la alimentación de lactantes y niños pequeños, y como tales, deben cumplir con criterios microbiológicos que aseguren su calidad e inocuidad. En este estudio, se analizó la calidad microbiológica de 24 preparados infantiles en polvo, empleando métodos reconocidos para el contaje e identificación de los microorganismos que pudieran estar presentes en estos productos.
De acuerdo con las normas INEN vigentes en el Ecuador que se aplican a estos productos INEN 707 (2013) e INEN 2516 (2010) [18,19], el 100% de los preparados de inicio cumplieron con los criterios microbiológicos de recuento de microorganismos aerobios y de enterobacterias. Sin embargo, el 50% de preparados infantiles de continuación sobrepasaron los valores establecidos tanto para aerobios como para enterobacterias considerados indicadores de calidad. Los valores de microorganismos aerobios aumentados no necesariamente implican un riesgo para el consumidor, sino que pueden estar relacionados con el incumplimiento de BPM en las plantas de fabricación, inadecuadas condiciones de almacenamiento, elaboración, distribución y transporte de materias primas, aditivos, productos intermedios y del producto terminado [29]. En el caso de recuentos aumentados de enterobacterias, estarían indicando prácticas de higiene deficientes o fallas de procesamiento, que podrían llegar a afectar la calidad y seguridad del alimento.
Al considerar lo que indica el Código de Prácticas de Higiene para los Preparados en Polvo para Lactantes y Niños Pequeños (CAC/RCP 66 2008) del Codex Alimentarius [11], “la fabricación inocua de estos productos depende del mantenimiento de un alto nivel de control sobre la higiene. Los criterios microbiológicos (...) están destinados a que los utilice el fabricante como medio de evaluación permanente de sus programas de higiene”, por lo que en el caso de este estudio, la presencia de enterobacterias en este tipo de preparados, constituye una alerta sobre las condiciones en las que se están elaborando los productos.
Un estudio en Chile reportó que el 11% de marcas analizadas sobrepasaron los niveles permitidos de aerobios, presentando recuentos de entre 1 x 103 y 5 x 103 UFC/g, mientras que los recuentos de enterobacterias fueron mayores a los de esta investigación y se encontraban entre 5,0 x 102 y 7,9 x 102 UFC/g en el 55% de las muestras [30]. En un estudio en Malasia, en que se analizó el contaje de aerobios, el 33,3% de las muestras de continuación y el 10% de los preparados de inicio, presentaron cantidades superiores a 104 UFC/g [31]. Estos datos indican que contajes elevados en este tipo de productos no son eventos aislados.
Uno de objetivos de esta investigación, fue detectar la presencia de indicadores de inocuidad en los productos. Salmonella se considera uno de los patógenos alimentarios más importante en alimentos procesados o derivados de lácteos y causante de ETA. Este microorganismo no se encontró en ninguna de las muestras analizadas, lo que coincide con el estudio de Heperkan, Dalkilic-Kaya, y Juneja en 2016 [32]. Por otro lado, Maçi et al. (2015) analizaron 70 muestras de farmacias, hospitales, supermercados y tiendas de comestibles en Albania y encontraron el 1,4% de preparados infantiles en polvo contaminados con Salmonella [33]. Infecciones asociadas al consumo de preparados infantiles contaminados con esta bacteria, se han reportado en muchos países [34, 35].
Otro patógeno responsable de ETA que tampoco se aisló de las muestras fue S. aureus, sin embargo, un estudio en China reportó su presencia en el 11,2% de productos y se identificaron genes productores de toxinas en muchas de las cepas aisladas [36].
Un patógeno oportunista transmitido por alimentos que se encontró fue Bacillus cereus en los preparados de continuación, este microorganismo formador de endosporas, puede resistir diversas condiciones de estrés, entre ellas, la pasteurización o UHT de la leche [37, 38]. También puede permanecer viable por largos periodos de tiempo en alimentos con actividad de agua (aw) por debajo de 0,85 [9], como los preparados infantiles en polvo cuya aw está entre 0,25 a 0,5 [39]. Una vez que las condiciones son favorables, las bacterias germinan y producen las enterotoxinas responsables de emesis y diarrea, lo que se ha observado en neonatos y pacientes con catéteres permanentes [40]. En China, encontraron que el 7,5% de los preparados infantiles tuvieron contajes ≥ 10 UFC/g y el 1,1% valores superiores a 100 UFC/g de B. cereus que se cree ha causado brotes en niños e infantes en ese país [41].
También en China, se evaluaron 880 muestras entre materias primas, equipos, personal y productos terminados de una empresa encargada de la manufactura de preparados infantiles, y se identificó B. cereus en el 22,7% de los productos terminados [42].
Hafnia alvei presente solo en preparados de continuación, puede considerarse un patógeno intestinal productor de toxinas citolíticas responsables de gastroenteritis [43]. Esta bacteria forma parte de la microbiota natural de la leche [44], y tiene la capacidad de formar biofilms en equipos y materiales utilizados en la industria de alimentos de manera que una adecuada desinfección y limpieza de estos, es fundamental [45].
Además en este estudio se determinó, cuáles eran los géneros de enterobacterias presentes en las muestras que son indicadores de la calidad e higiene de un alimento, y muchas de ellas pueden causar trastornos gastrointestinales, enterocolitis necrosante e infecciones sistémicas, enfermedades que han sido reportadas en niños menores de un año, siendo los bebés inmunocomprometidos o debilitados médicamente los más susceptibles [12]. Además, según se indica en el Código de Prácticas de Higiene para Alimentos con Bajo Contenido de Humedad CXC 75-2015, cuando se detectan patógenos como Salmonella o microorganismos indicadores de la higiene de los procesos, como las enterobacterias en el ambiente de la instalación del establecimiento y sus niveles superan el “criterio de decisión”, deberían tomarse medidas adecuadas para investigar la fuente de contaminación y eliminar o controlar los microorganismos presentes en el ambiente [9].
E. coli se identificó en uno de los preparados de continuación. Esta enterobacteria es un indicador de contaminación fecal. Su presencia en un alimento está asociada a la posibilidad de encontrar patógenos intestinales, de manera que un alimento contaminado con esta bacteria, no es apto para consumo. En un estudio similar, los investigadores reportaron 14% de fórmulas infantiles contaminadas con este bacilo Gram negativo [46].
Klebsiella oxytoca fue la enterobacteria aislada en mayor porcentaje en las muestras de inicio (41,7%), y también estuvo en los productos de continuación, aunque en menor porcentaje (25%). Este microorganismo está relacionado con contaminación ambiental y ha sido identificado en plantas y en el suelo de granjas lecheras [47]. Otros estudios también la han reportado en preparados infantiles en Nigeria y China [48, 49].
Otra enterobacteria aislada tanto en muestras de inicio como de continuación, fue Pantoea agglomerans. Aunque este microorganismo no se considera un patógeno que se transmite por alimentos, si ha sido implicado en sepsis por trauma o por uso de catéteres en pacientes hospitalizados [50]. En un estudio realizado en Irán se la identificó en 6,4% de preparados infantiles en polvo dispensados en farmacias de hospitales, los autores indican que la presencia de esta enterobacteria podría estar relacionada con ingredientes contaminados que son añadidos después de la etapa de secado y antes del envasado de estos productos [51]. En Ecuador, Carvajal (2013) analizó preparados infantiles en polvo utilizados en un Hospital Público de la ciudad de Guayaquil y reportó que en el 20,9% de muestras se identificaron especies de enterobacterias como Pantoea spp. y Enterobacter cloacae [52].
Enterobacter aerogenes aislado en productos de continuación, no se transmite por alimentos, pero es uno de los patógenos nosocomiales con amplia resistencia antimicrobiana [53].
También se aisló en preparados de inicio a Citrobacter freundii, que, si bien se considera un comensal del intestino de humanos y animales, hay datos que demuestran que puede causar enfermedades diarreicas por medio de la producción de toxinas [54]. Estos bacilos Gram negativos también fueron identificados en 6 de 75 preparados infantiles en Italia [55].
Microorganismos indicadores de fallas en la aplicación de Buenas Prácticas de Manufactura también se aislaron, por ejemplo, Pseudomonas spp. en el 8,3% de las muestras de inicio. Este microorganismo tiende a formar biofilms y su presencia puede deberse a sistemas inapropiados para la distribución y almacenamiento del agua para uso en la industria [56]. Se ha descrito que comprende entre el 70 al 90% de bacterias que están presentes en la leche cruda y puede desarrollarse a temperaturas inferiores a 7 °C, condición estándar de almacenamiento antes de ser pasteurizada en las industrias. Su presencia en los preparados infantiles en polvo, puede indicar que las condiciones de refrigeración que permiten controlar la carga bacteriana en la leche de vaca, han creado un medio óptimo de crecimiento para Pseudomonas spp. y que probablemente el proceso de tratamiento térmico es ineficiente [57]. Dogan y Boor (2003), aislaron 338 cepas de Pseudomonas spp. a partir de muestras de leche cruda, pasteurizada y del ambiente de 4 plantas de producción lechera [58]. Avellan y Parra (2019) analizaron preparados infantiles comercializados por distribuidoras y farmacias de un importante sector comercial de Guayaquil-Ecuador, encontrando Pseudomonas spp. en el 3% de las muestras [59].
Bacillus subtilis se identificó tanto en fórmulas de inicio como de continuación. Este microorganismo no es un enteropatógeno, pero está ampliamente distribuido en la naturaleza y puede contaminar la materia prima y el ambiente, además por su capacidad de formar biofilms puede ser persistente en los sistemas de agua de las industrias [60].
Una de las limitaciones de este estudio fue que no se analizó la presencia de Cronobacter sakazakii, debido a que no fue posible acceder a técnicas cromogénicas y moleculares como lo establece el protocolo de la FDA [61]. Este patógeno es causante de múltiples infecciones en lactantes y niños pequeños, particularmente en neonatos cuya muerte puede ocurrir en 40 – 80% de los casos y que ha estado implicado en casos de meningitis y septicemia [62]. Otra limitación fue que los resultados son exclusivamente aplicables a los productos y marcas analizadas, debido a que la selección de las muestras no fue aleatoria, por lo que es difícil la generalización de estos resultados a estos u otros productos y marcas.
En esta investigación a más del contaje de enterobacterias según las normas de la AOAC, también se sometió a las muestras a un proceso de pre-enriquecimiento selectivo para bacilos Gram negativos, aun cuando esto no consta en las Normas INEN. Se consiguió detectar enterobacterias inclusive en los preparados de inicio, donde los recuentos para estos microorganismos fueron negativos, esto se considera una de las fortalezas de este estudio. Estos resultados indican que estas bacterias están presentes y que puede ser necesario que las normas incluyan el pre-enriquecimiento como un mecanismo válido para asegurar su correcto aislamiento e identificación. Otra fortaleza es que se hizo el análisis de una variedad de preparados infantiles según el grupo de edad, nacionales e importados, que se comercializan en Quito. Igualmente, los métodos de contaje e identificación que se aplicaron en este estudio constan en las normas vigentes en el país y fueron previamente validados.
CONCLUSIÓN
Los resultados generados en este estudio muestran la necesidad de reforzar el control de calidad y de la aplicación de las Buenas Prácticas de Manufactura de los preparados infantiles que se comercializan en el país, en especial de los preparados de continuación donde el 50% presentaron contajes de microorganismos aerobios superiores a 103 UFC/g y presencia de enterobacterias, todos correspondientes a muestras de fabricación nacional. El aislamiento de enteropatógenos como B. cereus y Hafnia alvei constituye riesgo para los consumidores y la presencia de E. coli y otras enterobacterias implica la necesidad de reforzar la higiene y vigilancia del cumplimiento de BPM.
En esta investigación aplicamos un pre-enriquecimiento para aislar enterobacterias, aun cuando no está estipulado en la metodología recomendada en las normas, lo que podría indicar la necesidad de incluir este procedimiento en el análisis microbiológico y así asegurar la inocuidad y seguridad de estos preparados en polvo.
AGRADECIMIENTOS
A la Facultad de Ciencias Químicas de la Universidad Central del Ecuador, laboratorio de Microbiología General y Farmacéutica, donde se realizó el estudio. Esta investigación fue en su mayor parte financiada por los autores.
CONTRIBUCIONES DE LOS AUTORES
Kimberly Carrión y Rommy Terán, han participado en la concepción de la investigación y diseño del estudio; Kimberly Carrión realizó los análisis microbiológicos; Kimberly Carrión, Lorena Goetschel y Rommy Terán analizaron e interpretaron los datos; Kimberly Carrión, Lorena Goetschel y Rommy Terán redactaron el manuscrito; Lorena Goetschel y Rommy Terán revisaron críticamente el contenido intelectual del manuscrito.
CONFLICTO DE INTERESES
Los autores declaran no tener conflicto de intereses en relación a la publicación de este artículo.
Referencias
[1] Brahm, P, & Valdés, V. (2017). Beneficios de la lactancia materna y riesgos de no mamantar. Revista Chilena de Pediatría, 88(1),15-21.doi: http://dx.doi.org/10.4067/S0370-41062017000100001
[2] Organización Mundial de la Salud. (2017). Metas Mundiales de Nutrición 2025: Documento Normativo Sobre Lactancia Materna [Global Nutrition Targets 2025: Breastfeeding]. Recuperado de https://bit.ly/3ymq5xq
[3] Freire, W. B., Ramírez-Luzuriaga, M. J., Belmont, P., Mendieta, M. J., Silva-Jaramillo, K., Romero, N., Sáenz, K., Piñeiros, P., Goméz, L. F., & Monge, R. (2014). Tomo I: Encuesta Nacional de Salud y Nutrición de La Población de Cero a 59 Años ENSANUT- ECU 2012. Ministerio de Salud Pública/Instituto Nacional de Estadísticas y Censos. Quito-Ecuador.
[4] Organización Mundial de la Salud, & Organización Panamericana de la Salud. (2016). La Lactancia Materna En El Siglo XXI. The Lancet 1-8. Recuperado de https://www.paho.org/hq/dmdocuments/2016/LactanciaMaternaEnSigloXXI-April15.pdf
[5] Serrano, M., Pozo, M., Medina, D., Viteri, J. J., & Lombeida, E. (2019). Boletín Técnico: Encuesta Nacional de Salud y Nutrición, 2018 Indicadores de Salud y Nutrición de La Población Ecuatoriana. Recuperado de https://www.ecuadorencifras.gob.ec/documentos/web-inec/Estadisticas_Sociales/ENSANUT/ENSANUT_2018/BoletinENSANUT28_12.pdf
[6] Hernández, V. (2011). Fórmulas Infantiles. Revista Gastrohnup,13(2), 531-536. Recuperado de http://revgastrohnup.univalle.edu.co/a11v13n2s1/a11v13n2s1art5.pdf
[7] Dalmau Serra, J., Ferrer Lorente, B., & Vitoria Miñana, I. (2015). Lactancia artificial. Pediatría Integral,19(4), 251-259. Recuperado de https://www.pediatriaintegral.es/wp-content/uploads/2015/xix04/03/n4-251-259_Jaime%20Dalmau.pdf
[8] Ferrer Lorent, B., & Dalmau Serra, J. (2005). Fórmulas de continuación y fórmulas de crecimiento. Acta Pediátrica Española, 63, 471-475. Recuperado de https://bit.ly/3DszjvI
[9] Organización Mundial de la Salud, & Organización de las Naciones Unidas para la Alimentación y la Agricultura. (2018). Código de prácticas de higiene para alimentos con bajo contenido de humedad CXC 75-2015. Recuperado de https://bit.ly/3jr5eET
[10] Organización de las Naciones Unidas para la Alimentación y la Agricultura, & Organización Mundial de la Salud. (2017). Norma para alimentos envasados para lactantes y niños CODEX STAN 73-1981. Recuperado de https://bit. ly/3sYnlW7
[11] Organización de las Naciones Unidas para la Alimentación y la Agricultura, & Organización Mundial de Salud. (2008). CAC/RCP 66 - 2008 Código de Prácticas de Higiene Para Los Preparados En Polvo Para Lactantes y Niños Pequeños. Recuperado de https://bit.ly/3BpmDnw
[12] Food and Agriculture Organization of the United Nation, & World Health Organization. (2004). Enterobacter sakazakii and other microorganisms in powdered infant formula. Recuperado de http://www.fao.org/3/y5502e/y5502e.pdf
[13] Rodríguez-Urrego, J., Herrera-León, S., Echeita-Sarriondia, A., Soler, P., Simon, F., Mateo, S., & Investigation team. (2010). Nationwide Outbreak of Salmonella Serotype Kedougou Associated with Infant Formula, Spain, 2008. Eurosurveillance, 15(22), 1-5. doi: https://doi.org/10.2807/ese.15.22.19582-en
[14] Van Acker, J., De Smet, F., Muyldermans, G., Bougatef, A., Naessens, A., & Lauwers, S. (2001). Outbreak of Necrotizing Enterocolitis Associated with Enterobacter sakazakii in Powdered Milk Formula. Journal of Clinical Microbiology, 39(1), 293-297. doi: https://doi.org/10.1128/JCM.39.1.293-297.2001
[15] Agencia Nacional de Regulación, Control y Vigilancia Sanitaria. (2017b). Normativa Técnica Sanitaria Para Alimentos Procesados. Recuperado de https://www.controlsanitario.gob.ec/wp-content/uploads/downloads/2018/03/ARCSA-DE-067-2015-GGG_Alimentos-Procesados_incluye-RESOL-019-y-010-2.pdf
[16] Agencia Nacional de Regulación, Control y Vigilancia Sanitaria. (2017a). Arcsa informa sobre fórmulas lácteas infantiles contaminadas con Salmonella. Recuperado de https://bit.ly/3gHlEqW
[17] Agencia Nacional de Regulación, Control y Vigilancia Sanitaria. (2019). Actualización N° 2 | alerta sanitaria sobre lote 2958-004 de producto fórmula infantil Blemil Plus 2 arroz- 400 g contaminado con Salmonella. Recuperado de https://bit.ly/2XYJB6A
[18] Instituto Ecuatoriano de Normalización. (2013). Norma Técnica Ecuatoriana NTE INEN 707:2013 Preparados de inicio para la alimentación de lactantes. Requisitos. Quito. Recuperado de https://www.normalizacion.gob.ec/buzon/normas/nte_inen_707-3.pdf
[19] Instituto Ecuatoriano de Normalización. (2010). Norma Técnica Ecuatoriana NTE INEN 2516:2010 Preparados de continuación para la alimentación de lactantes. Requisitos.Quito. Recuperado de https://www.normalizacion.gob.ec/buzon/normas/2516.pdf
Association of Official Analytical Chemists. (2002). AOAC Official Method 990.12 Aerobic Plate Count in Foods. Recuperado de https://www.edgeanalytical.com/wp- content/uploads/Food_AOAC-990.12.pdf
[21] Association of Official Analytical Chemists. (2006). Official Method 2003.01 Enumeration of Enterobacteriaceae in Selected Foods. Recuperado de https://multimedia.3m.com/mws/media/1759929O/aoac-oma-2003-01-enumeration-of- enterobaceriaceae-in-foods.pdf
[22] Tortorello, M. L. (2003). Indicator organisms for safety and quality—Uses and methods for detection: Minireview. Journal of AOAC INTERNATIONAL, 86(6), 1208-1217. doi: https://doi.org/10.1093/jaoac/86.6.1208
[23] Tallent, S., Knolhoff A., Rhodehamel J., Bennett R., & Harmon S. (2020). BAM Chapter 14: Bacillus cereus | FDA. Recuperado de https://bit.ly/3jtSspc
[24] Tallent, S., Hait J., Bennett R., & Lancette G. (2019). BAM Chapter 12: Staphylococcus aureus | FDA. Recuperado de https://bit.ly/38lqoxU
[25] Merck KGaA. (2010). Microbiology Manual. Darmstadt. Recuperado de http://www.laboquimia.es/pdf_catalogo/MERCK_Manual_de_microbiologia_12a_edicio n.pdf
[26] International Organization for Standardization. (2017). ISO 6579-1:2017 Microbiology of the Food Chain-Horizontal Method for the Detection, Enumeration and Serotyping of Salmonella - Part 1: Detection of Salmonella spp. Recuperado de https://www.triphuc.com/wp-content/uploads/2019/10/ISO-6579-1-2017.pdf
[27] U.S. Food & Drug Administration. (2002). Laboratory methods - Isolation and Enumeration of Enterobacter sakazakii from dehydrated powdered infant formula. Recuperado de https://bit.ly/38mMjEX
[28] Microgen Bioproducts Ltd. (2007). Microgen GnA+B-ID. Recuperado de http://repositorio.puce.edu.ec/bitstream/handle/22000/12143/MICROGEN-GN-ID-MID64-641-65.%5B2%5D.pdf
[29] Aycicek, H., Oguz, U., & Karci, K. (2006). Determination of Total Aerobic and Indicator Bacteria on some raw eaten vegetables from wholesalers in Ankara, Turkey. International Journal of Hygiene and Environmental Health, 209(2), 197-201. doi: https://doi.org/10.1016/j.ijheh.2005.07.006
[30] Parra-Flores, J., Cerda-Leal, F., Contreras, A., Valenzuela-Riffo, N., Rodríguez, A., & Aguirre, J. (2018). Cronobacter sakazakii and microbiological parameters in dairy formulas asociated with a food alert in Chile. Frontiers in Microbiology, 9, 1-9. doi: https://doi.org/10.3389/fmicb.2018.01708
[31] Abdullah Sani, N., Hartantyo, S. H. P., & Forsythe, S. J. (2013). Microbiological assessment and evaluation of rehydration instructions on powdered infant formulas, follow-up formulas, and infant foods in Malaysia. Journal of Dairy Science, 96(1), 1-8. doi:_https://doi.org/10.3168/jds.2012-5409
[32] Heperkan, D., Dalkilic-Kaya, G., & Juneja, V. (2016). Cronobacter sakazakii in baby foods and baby food ingredients of dairy origin and microbiological profile of positive samples. LWT - Food Science and Technology, 75, 402-407. doi: https://doi.org/10.1016/j.lwt.2016.09.013
[33] Maçi, R., Bijo, B., Xinxo, A., Shehu, F., & Memoçi, H. (2015). Prevalence of Salmonella spp. in imported powered infant formula (PIF). Albanian Journal of Agricultural Sciences, 14(3), 236-240. Recuperado de https://bit.ly/3ywGnUu
[34] Cahill, S. M., Wachsmuth, I. K., Costarrica, M. L., & Embarek, P. K. B. (2008). Powdered Infant Formula as a Source of Salmonella Infection in Infants. Clinical Infectious Diseases, 46(2), 268-273. doi: https://doi.org/10.1086/524737
[35] Park, J. K., Seok, W. S., Choi, B. J., Kim, H. M., Lim, B. K., Yoon, S. S., Kim, S., Kim, Y. S., & Park, J. Y. (2004). Salmonella enterica Serovar London Infections Associated with Consumption of Infant Formula. Yonsei Medical Journal, 45(1), 43-48. doi: https://doi.org/10.3349/ymj.2004.45.1.43
[36] Wang, X., Meng, J., Zhang, J., Zhou, T., Zhang, Y., Yang, B., Xi, M., & Xia, X. (2012). Characterization of Staphylococcus aureus Isolated from powdered infant formula milk and infant rice cereal in China. International Journal of Food Microbiology, 153(1-2), 142-147. doi: https://doi.org/10.1016/j.ijfoodmicro.2011.10.030
[37] Lesley, M. B., Ernie, S. R., Kasing, A., & Son, R. (2017). Detection of Bacillus cereus in formula milk and ultra high temperature (UHT) treated milk products. International Food Research Journal, 24(3), 985-989. Recuperado de http://www.ifrj.upm.edu.my/24%20(03)%202017/(12).pdf
[38] Matug, S. M., Aidoo, K. E., & Elgerbi, A. M. (2015). Microbiological examination of infant food and feed formula. Emergent Life Sciences Research, 1(1), 46-51. Recuperado de https://bit.ly/3t8qz9y
[39] Medina, G. A., Loredo A., & Aguilar, N. (2014). Cronobacter sakazakii: Un patógeno emergente transmitido por alimentos. Acta Química Mexicana, 6(12), 24-29. Recuperado de https://bit.ly/3gJhMFZ
[40] European Food Safety Authority. (2013). Scientific opinion on nutrient requirements and dietary intakes of infants and young children in the European Union. EFSA Journal,11(10), 1-103. doi: https://doi.org/10.2903/j. efsa.2013.3408
[41] Pei, X., Yang, S., Zhan, L., Zhu, J., Song, X., Hu, X., Liu, G., Ma, G., Li, N., & Yang, D. (2018). Prevalence of Bacillus cereus in powdered infant and powdered follow-up formula in China. Food Control, 93, 101-105. doi: https://doi.org/10.1016/j.foodcont.2018.05.049
[42] Jianyun, S., Hu, X., Lan, G., & Dong, K. (2017). Investigation on microbial contamination of infant formula powder during production process. Chinese Journal of Food Hygiene, 29(4), 474-477. Recuperado de https://bit.ly/3sXFQJZ
[43] Abbott, S. L., Moler, S., Green, N., Tran, R. K., Wainwright, K., & Janda, J. M. (2011). Clinical and Laboratory Diagnostic Characteristics and Cytotoxigenic Potential of Hafnia alvei and Hafnia paralvei Strains. Journal of Clinical Microbiology, 49(9), 3122-3126. doi: https://doi.org/10.1128/JCM.00866-11
[44] Pukančíková, L., Lipničanová, S., Kačániová, M., Chmelová, D., & Ondrejovič, M. (2016). Natural microflora of raw cow milk and their enzymatic spoilage otential. Nova Biotechnologica et Chimica, 15(2), 142-155. doi: https://doi.org/10.1515/nbec-2016-0015
[45] Souza Viana, E., Martino Campos, M. E., Reis Ponce, A., Cuquetto Mantovani, H., & Dantas Vanetti, M. C. (2009). Biofilm formation and acyl homoserine lactone production in Hafnia alvei isolated from raw milk. Biological Research, 42(4), 427-436. doi: http://dx.doi.org/10.4067/S0716-97602009000400004
[46] Sezer, C., Vatansever, L., & Bilge, N. (2015). The microbiological quality of infant milk and follow - on formula. Van Veterinary Journal, 26(1), 31-34. Recuperado de https://dergipark.org.tr/en/download/article-file/217577
[47] Zadoks, R. N., Griffiths, H. M., Munoz, M. A., Ahlstrom, C., Bennett, G. J., Thomas, E., & Schukken, Y. H. (2011). Sources of Klebsiella and Raoultella species on dairy farms: Be careful where you walk. Journal of Dairy Science, 94(2), 10451051. doi: https://doi.org/10.3168/jds.2010-3603
[48] Babalola, M., & Adebayo, O. (2016). Detection of Chronobacter sakazakii and other enteropathogenic bacteria from selected brands of commercial powdered foods in Nigeria. British Microbiology Research Journal, 11(4), 1-13. doi: https://doi.org/10.9734/BMRJ/2016/17912
[49] Xiao-hong, X., Ping, H., Lin-lin, W., Da-wei, Y., & Yu-zhong, Z. (2012). Detection and analysis of Enterobacteriaceae and other bacteria in commercial infant formula powder in Lanzhou city. Chinese Journal of Health Laboratory Technology. Recuperado de https://bit.ly/3gFtAZF
[50] Cruz, A. T., Cazacu, A. C., & Allen, C. H. (2007). Pantoea agglomerans , a Plant Pathogen Causing Human Disease. Journal of Clinical Microbiology, 45(6), 1989-1992. doi: https://doi.org/10.1128/JCM.00632-07
[51] Mardaneh, J., & Soltan Dallal, M. M. (2013). Isolation, identification and antimicrobial susceptibility of Pantoea (Enterobacter) agglomerans isolated from consumed powdered infant formula milk (PIF) in NICU ward: first report from Iran. Iranian Journal of Microbiology, 5(3), 263-267. Recuperado de https://bit.ly/3zwBQCN
[52] Carvajal, D. (2013). Estudio de la presencia de Enterobacter sakazakii en fórmulas infantiles en polvo proporcionadas a pacientes lactantes de un hospital público de la ciudad de Guayaquil. Escuela Superior Politécnica del Litoral, Guayaquil. Recuperado de https://bit.ly/3ztyMap
[53] Davin-Regli, A., & Pages, J. M.. (2015). Enterobacter aerogenes and Enterobacter cloacae; versatile bacterial pathogens confronting antibiotic treatment. Frontiers in Microbiology, 6(MAY), 1-10. doi: https://doi.org/10.3389/ fmicb.2015.00392
[54] Liu, L., Chen, D., Liu, L., Lan, R., Hao, S., Jin, W., Sun, H., Wang, Y., Liang, Y., & Xu, J. (2018). Genetic Diversity, Multidrug Resistance, and Virulence of Citrobacter freundii From Diarrheal Patients and Healthy Individuals. Frontiers in Cellular and Infection Microbiology, 8(JUL), 1-10. doi: https://doi.org/10.3389/fcimb.2018.00233
[55] Giammanco, G. M., Aleo, A., Guida, I., & Mammina, C. (2011). Molecular Epidemiological Survey of Citrobacter freundii Misidentified as Cronobacter spp. (Enterobacter sakazakii) and Enterobacter hormaechei Isolated from Powdered Infant Milk Formula. Foodborne Pathogens and Disease, 8(4), 517-525. doi: https://doi.org/10.1089/fpd.2010.0719
[56] Ma, X., Zhang, G., Li, G., Wan, Y., Sun, H., Wang, H., & Shi, B. (2018). Biofilm bacterial community transition under water supply quality changes in drinking water distribution systems. Environmental Science: Water Research & Technology, 4(5), 644-653. doi: https://doi.org/10.1039/C8EW00033F
[57] De Jonghe, V., Coorevits, A., Van Hoorde, K., Messens, W., Van Landschoot, A., De Vos, P., & Heyndrickx, M. (2011). Influence of storage conditions on the growth of Pseudomonas species in refrigerated raw milk. Applied and Environmental Microbiology, 77(2), 460-470. doi: https://doi.org/10.1128/AEM.00521-10
[58] Dogan, B., & Boor, K. (2003). Genetic diversity and spoilage potentials among Pseudomonas spp. Isolated from fluid milk products and dairy processing plants. Applied and Environmental Microbiology, 69(1), 130-138. doi: https://doi.org/10.1128/AEM.69.1.130-138.2003
[59] Avellan, F., & Parra, Y. (2019). Aislamiento e identificación de Enterobacter sakazakii en una marca de fórmulas lácteas del mercado local. Universidad de Guayaquil, Guayaquil.Recuperado de https://bit.ly/38pt6Ti
[60] Earl, A. M., Losick, R., & Kolter, R. (2008). Ecology and Genomics of Bacillus Subtilis. Trends in Microbiology, 16(6), 269-275. doi: https://doi.org/10.1016/j.tim.2008.03.004
[61] U.S. Food & Drug Administration. (2012). BAM Chapter 29: Cronobacter | FDA. Recuperado de https://bit.ly/3BlsIBu
[62] Kent, R., Fitzgerald, G., Hill, C., Stanton, C., & Ross, P. (2015). Novel approaches to improve the intrinsic microbiological safety of powdered infant milk formula. Nutrients, 7, 1217-1244. doi: https://doi.org/10.3390/nu7021217