Evaluación de grafeno y magnetita como membranas de intercambio de electrones en celdas de combustible microbianas con sustratos orgánicos para producir bioelectricidad
Evaluation of graphene and magnetite as electron exchange membranes in microbial fuel cells with organic substrates to produce bioelectricity
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
Recepción: 17 Agosto 2020
Aprobación: 12 Abril 2021
Resumen: En la actualidad, el desafío más importante del desarrollo energético es la incorporación de fuentes renovables de energía usando diversas tecnologías. Entre estos sistemas se incluyen diferentes alternativas como la generación de energía a partir de biomasa. Una forma de estos sistemas de biorreactores electroquímicos catalizados por microorganismos para la generación de formas energéticas usando biomasa como sustrato, son las celdas de combustible microbianas, que de acuerdo con sus características estructurales producen bioelectricidad conforme se degrada cierto requerimiento nutricional, considerado como, un contaminante potencial. Sin embargo, los bajos niveles de voltaje y densidad de potencia generados por una celda de combustible limitan su aplicabilidad a gran escala. Esta investigación tiene como objetivo evaluar el grafeno y magnetita como membranas de intercambio de electrones para mejorar la estabilidad de voltaje y eficiencia en la generación de bioelectricidad, utilizando como inóculo suelo de páramo alto andino del Cantón Colta, mediante un sistema de tres conglomerados para obtener una muestra compuesta, de la cual fueron analizadas sus características físico-químicas. El sustrato empleado fue una mezcla 50:50 de frutas (naranja: Citrus x sinensis Osbeck, banano: Musa acuminata L. y manzana: Pyrus malus L.) y vegetales (arveja: Pisum sativum L., haba: Vicia faba L., zapallo: Cucurbita máxima Duchesne) en estado de descomposición; se analizó su contenido de Carbono, Nitrógeno, Hidrógeno y Azufre. La membrana de grafeno se obtuvo mediante exfoliación directa de óxido de grafito, previamente tratado en baño ultrasónico, sobre un tejido de fibra de carbono, mientras que la magnetita se sintetizó a partir de cloruro férrico y cloruro ferroso. El voltaje generado por las celdas fue monitoreado durante quince días consecutivos, posteriormente se estimó la eficiencia de los materiales usados como membranas, a través de una comparación de densidad de potencia y la degradación de su contenido. El voltaje promedio obtenido por celdas con grafeno fue 131 mV, su densidad de potencia de 9,17 mW/m2 y una degradación del sustrato de 8,60% (N), 35,29% (C), 24,49% (H) y 12,16% (S), mientras que celdas con magnetita consiguieron una degradación de 6,44% (N), 24,05% (C), 19,02% (H) y 11,35% (S) , un voltaje de 14 mV y una densidad de potencia de 0,22 mW/m2 concluyendo que la membrana de grafeno tiene mayor rendimiento puesto que logró una densidad de potencia 42 veces mayor en relación a la magnetita.
Palabras clave: Densidad de Potencia, Degradación, biomasa residual, electroactividad.
Abstract: Currently, the most important challenge in energy development is the incorporation of renewable sources of energy using various technologies. These systems include different alternatives such as power generation from biomass. One form of these microorganism-catalyzed electrochemical bioreactor systems for the generation of energy forms using biomass as a substrate are microbial fuel cells, that according to their structural characteristics, produce bioelectricity as a certain nutritional requirement considered potentially polluting is degraded. However, the low levels of voltage and power density generated in a fuel cell limit their large-scale applicability. This research aims to evaluate graphene and magnetite as electron exchange membranes to improve voltage stability and efficiency in the generation of bioelectricity, for this, representative samples of high Andean moor soil from Canton Colta were taken for its use as inoculum, through a system of three clusters finally obtaining a composite sample. The substrate used was a 50:50 mixture of fruits (orange: Citrus sinensis, banana: Musa acuminata L. and apple: Pyrus malus L.) and vegetables (pea: Pisum sativum L., bean: Vicia faba L., squash: Cucurbita Duchesne maximum) in a decomposed state. Physicochemical characteristics of the inoculum and percentages of Carbon, Nitrogen, Hydrogen and Sulfur of the substrate were analyzed. The graphene membrane was obtained by direct exfoliation of graphite oxide, previously treated in an ultrasonic bath, on a carbon fiber fabric. Magnetite was synthesized from FeCl2 and FeCl3. The voltage values generated by twelve cells were monitored, three for each membrane variation (graphene, magnetite, white and white with magnet) for fifteen consecutive days as a Bach reactor. The results were statistically analyzed taking average values and considering the difference between treatments. The efficiency of the materials used as membranes was established through a comparison of power density and degradation of its content. The average voltage obtained was 131 mV given by graphene membrane cells, the power density of 9.17 mW/m2 and a substrate degradation of 8.60% (N), 35.29% (C), 24.49% (H) and 12. 16% (S), concluding that the graphene membrane has higher performance since it achieved a power density 42 times higher in relation to magnetite.
Keywords: Power Density, Degradation, residual biomass, electroactivity.
INTRODUCCIÓN
Al utilizar combustibles fósiles como la mayor fuente de energía, ocasionan impactos ambientales en los procesos de extracción y combustión. Para los procesos de extracción, se requiere la remoción de flora y fauna del sector, provocando incluso pérdidas de ecosistemas, mientras que la refinación y su combustión genera emisión de gases, metales pesados, material particulado, que en su conjunto son los causantes de la degradación ambiental del planeta, sin contar con los posibles derrames de crudo que puede suceder.
Según el informe del Ministerio de Electricidad y Energía Renovable-Ecuador, en el 2016 se consumieron 1185 millones de galones de gasolina y 1993 millones de galones de diesel oil, como los derivados de petróleo más utilizados, lo cual ha generado impactos negativos en el ambiente, generando la necesidad de encontrar fuentes alternativas de energía, una de estas alternativas puede ser las celdas de combustible microbiano (CCMs), las cuales han generado nuevas expectativas como métodos de obtención de energías limpias. Estas se plantean además como una alternativa viable para solucionar conflictos ambientales y sociales vigentes tales como la polución presente en cuerpos hídricos y la falta de acceso a energías limpias.
Las CCMs han sido ampliamente utilizadas, principalmente para el tratamiento de aguas residuales, la recuperación de suelos y biosensores, sin embargo, en el momento de escalar los ensayos de laboratorio, la baja potencia obtenida ha limitado su aplicación [1], ya que estas no generan voltajes uniformes y constantes a lo largo del tiempo. Entre las posibles causas de variación se pueden destacar la composición de las celdas, perdida de electrones, la comunidad bacteriana y cambios en las condiciones ambientales [2].
En estudios antes realizados, se observa una producción de bioelectricidad variable, ocasionando el consumo de combustible microbiano a lo largo del tiempo. La caída final de voltaje podría deberse a dos razones: el desgaste del material utilizado como electrodo ánodo que afecta a la captación de electrones en la cámara anódica (CA), al mismo tiempo afecta a las reacciones que se llevan a cabo en la cámara catódica (CC); y, la fuente nutricional limitada, provocando posiblemente competencia, antagonismo y nueva selección en el consorcio bacteriano de la CA, que dependiendo de su resistencia al estrés nutricional pudo afectar al desempeño en la producción bioeléctrica en las celdas de combustibles microbianas [3].
PROPUESTA
La búsqueda de una alternativa para la obtención de energía limpia y sostenible es un paso predominante para el futuro, además esto va de la mano con la conservación de recursos y el aprovechamiento de residuos. Es por ello que existe la importancia de desarrollar investigaciones en las que se potencie estas alternativas. Desde años atrás, este tipo de estudios han causado un gran impacto positivo por sus aportes.
Las CCMs, son compartimentos electroquímicos que usan microorganismos como catalizadores para producir bioelectricidad, a partir de las transformaciones redox de materia orgánica, utilizando sustratos inorgánicos presentes en la biomasa o aguas residuales [4]. En artículos publicados, se detalla la estructura básica de este tipo de celdas, enfocándose en sus principios de funcionamiento y su evolución en el paso del tiempo, además de resaltar los rangos de voltaje obtenidos en una celda de composición básica [5]. El principio de funcionamiento es sencillo, se requiere dos cámaras, una donde los electrones sean liberados y otra donde sean captados, y entre estas dos, debe existir una membrana como separador.
Sin embargo, la producción de bioelectricidad es variable, arroja valores fluctuantes de voltaje, desde la etapa de adaptación de los microorganismos, hasta un valor máximo de producción, y con el pasar de los días los valores caen, dicho inconveniente genera la necesidad de mejorar el diseño, utilizar otros materiales que posiblemente colaboren para obtener valores estables de producción de voltaje.
Se necesita materiales con alta eficiencia en la transferencia de electrones, de los cuales, llaman la atención los nanomateriales, tales como óxido de grafeno reducido (RGO) y magnetita, que podrían servir como redes conductoras adicionales y biopelículas electroactivas [6]. Por lo que, este estudio se enfoca en la aplicación de sustratos y materiales óptimos para la generación estable de voltaje a lo largo del tiempo en el interior de una CCM.
MATERIALES Y MÉTODOS
Lugar de muestreo del inóculo
Se tomaron muestras de suelo de la parroquia Villa La Unión, perteneciente al Cantón Colta situado en la Provincia de Chimborazo. El área considerada se esquematiza en la Figura 1, para la localización y referenciación geográfica del área muestreada, se utilizó el equipo Garmin GPSMAP 78sc, las coordenadas obtenidas se muestran en unidades UTM 78°50’48,1776” W 1°44’42,3880” a una altitud de 4000 m.s.n.m
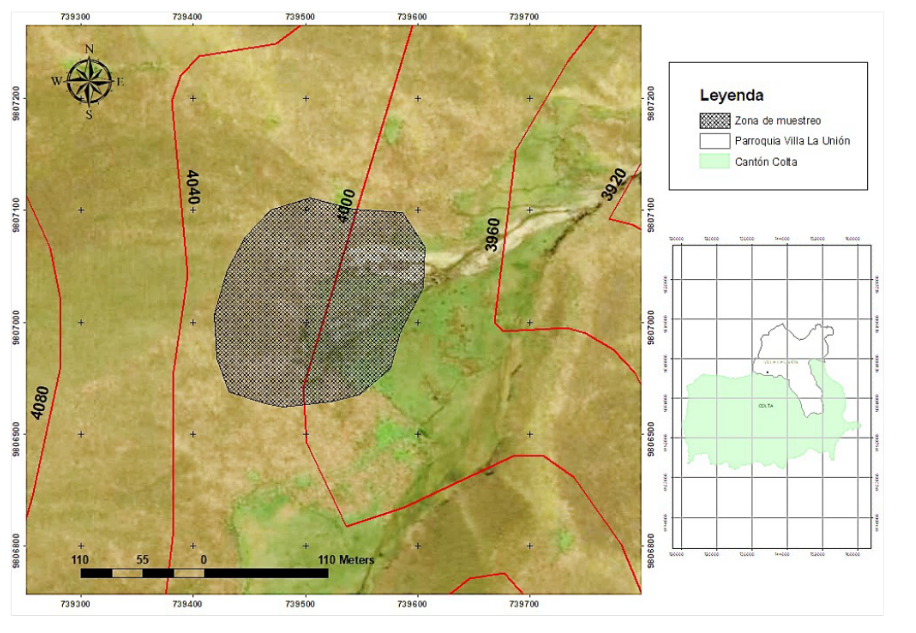
FIGURA 1.
Sitio de muestreo.
El área se dividió en conglomerados, formadas por cinco parcelas de 10 m de lado aproximadamente y una separación de 100 m entre una a otra.
Para la obtención de la muestra compuesta, mediante barreno, se tomó cuatro submuestras a una profundidad de 20 cm en cada vértice, y una en el centro de cada parcela, dando un total de 5 submuestras de aproximadamente 625 g cada una. La muestra compuesta obtenida de 3125 g fue almacenada en bolsas herméticas, de los cuales 1000 g fueron dispuestos para análisis de laboratorio, 1000 g para uso como sustrato en las CCMs y el material restante fue almacenado a 4°C.
Características del suelo
Las muestras de suelo fueron analizadas por técnicos especialistas de la Agencia de Regulación y Control Fito y Zoosanitario (AGROCALIDAD), los parámetros analizados se redactan en la Tabla 2 en la sección de resultados.
Configuración de las CCM
Como ya se mencionó, las celdas de combustible microbiano son dispositivos que utilizan microorganismos para convertir la energía química de un sustrato en energía eléctrica. Y se utiliza los electrones de los microorganismos producidos en su actividad metabólica, los cuales se transfieren a un electrodo (ánodo) en lugar de un aceptor natural de electrones (como el oxígeno). El dispositivo se compone de una cámara anódica anaerobia y una catódica aerobia, separadas por una fibra de carbono donde se forma la biopelícula microbiana. La materia orgánica contenida en la cámara anódica se oxida, y se generan electrones y protones de manera proporcional, los electrones se remueven rápidamente por acción de la biopelícula en el circuito eléctrico de la celda, mientras que los protones se desplazan fuera de la biopelícula para dirigirse hacia el cátodo [7]. Además, los electrones generados se ubican en la parte externa de la superficie celular esperando a un aceptor final, Figura 2, [8,9].
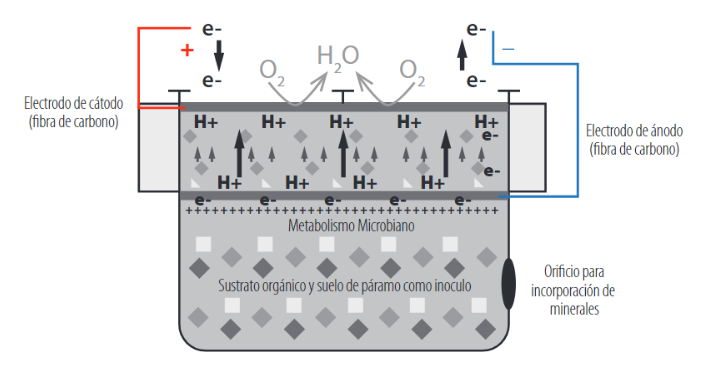
FIGURA 2.
Prototipo esquemático de CCM utilizado para generar bioelectricidad a partir de residuos orgánicos.
La configuración final muestra el cátodo parcialmente expuesto al aire, la cámara es de acrílico traslúcido de 3 mm de espesor.
La cámara anódica es un cubo de 5 cm de arista, en dos de sus caras se colocaron tapones de caucho para el suministro de nutrientes y la purga de aire del interior, en su parte superior se colocó fibra de tejido de carbono como membrana de captación de electrones. El cátodo se estructuró a partir de cinco láminas de material similar a la cámara anódica dispuestas una sobre otra, en cuyo espacio superior se introdujo fibra de carbono expuesta al aire. La cámara anódica y catódica fueron fijadas una a otra mediante tornillos galvanizados de 4 cm de longitud, Figura 3.

FIGURA 3.
CCM de configuración simple.
Sustrato Orgánico
El sustrato constituye el combustible a partir del cual se genera la energía. En los primeros años, sustratos simples como glucosa y acetato eran de uso general, pero en los últimos años las investigaciones se centran en la utilización de sustratos menos convencionales con el fin de utilizar la biomasa presente en aguas residuales de diverso tipo y adicionalmente depurarlas y generar energía [10].
Para este caso se empeló una combinación de residuos sólidos de frutas y vegetales en relación 50:50 en peso. Se colocaron 1,5 g de frutas en proporciones iguales (Naranja: Citrus sinensis, Banano: Musa acuminata y Manzana: Pyrus malus ) junto con una mezcla de verduras (Vaina de arveja: Pisum sativum, Haba: Vicia faba, Zapallo: Cucurbita máxima). Estos residuos fueron obtenidos del Mercado Popular “La Condamine” de la ciudad de Riobamba, los cuales fueron triturados hasta obtener un diámetro aproximado de 3 mm.
Preparación de la cámara anódica
El inóculo utilizado en la cámara anódica de las CCMs provino de suelos de páramo no intervenido que, generaron valores de voltaje relevantes en investigaciones anteriores [5]. Se pesó 3 g de suelo para mantener una relación de 1:1 de la mezcla frutas-vegetales, dicha relación ya se utilizó en un estudio anterior, mostrando buenos resultados [11].
Los minerales fueron suministrados a la cámara anódica a partir de una solución constituida por 5 mL de cloruro de sodio al 0,9% aforadas con agua destilada hasta 100 mL, y de esta se dotaron 5 mL a cada una de las celdas empleadas en la investigación.
Sistema de adquisición de datos
La lectura y almacenamiento de datos de voltaje generados por las CCMs fueron obtenidas por un sistema de adquisición de datos conformado por una DAQ NI USB-6009 de 8 entradas y 14 bits operada bajo un modelo de recolección digital ejecutado por el software LabView, con un intervalo de recolección de datos de sesenta segundos por un período de 15 días de monitoreo, considerando a cada lapso de 24 horas como un ciclo independiente.
Preparación de las CCM para el monitoreo
Esterilización
Los materiales empleados en la construcción de las CCMs fueron sumergidos en una solución de hipoclorito de sodio al 5% durante 60 minutos. Al cabo de este tiempo, dichos componentes fueron lavados usando agua comercial para nuevamente ser sumergidos en esta por 24 horas.
Pre-tratamiento de la membrana
Para eliminar todas las impurezas presentes en el tejido de fibra de carbono, se inició con el corte de la fibra, formando cuadrados de 8x8 cm, a continuación, estos fueron sumergidos en acetona industrial por un lapso de 12 horas, al concluir este tiempo, los cortes fueron lavados cinco veces con agua destilada para eliminar los sobrantes del disolvente, luego se sumergió la fibra en una solución de peroxidisulfato de amonio, previamente preparada con 50 g del soluto en 250 mL de agua, por 15 minutos, este procedimiento se repitió con 100 mL de ácido sulfúrico al 96%. Para finalizar, se calentaron los cortes de fibra a 450°C en un horno mufla por 30 minutos, se lavaron en agua destilada y se almacenaron en bolsas herméticas hasta su utilización. Paralelamente, las fibras que formaron parte de los cátodos, fueron tratadas únicamente con enjuagues de agua destilada [12].
Síntesis de Magnetita
Para una mayor conversión de viruta de hierro a FeCl2, se obtuvo cloruro ferroso, para lo cual se sumergió 100 g de viruta de hierro, en 500 mL de una solución 7,4 M de HCl, a 80°C por tres horas, luego se dejó reposar hasta alcanzar la temperatura ambiente [13].
De forma simultánea, se preparó una solución usando 0,85 mL de HCl a una concentración 12,1 M y 25 mL de agua destilada, la cual fue burbujeada con nitrógeno por 30 minutos. Se añadió 13 mL de FeCl3 al 40% y 14,2 mL de FeCl2 en la solución anterior. Se agitó vigorosamente con ayuda de una varilla de vidrio y se adicionó 250 mL de una solución de NaOH 1,5 M gota por gota. Para la recolección del precipitado se utilizó un imán de neodimio y se desechó el sobrenadante. El precipitado obtenido se lavó con agua destilada, se centrifugó a 4000 rpm por 10 minutos, y se repitió tres veces. Finalmente, el producto resultante se secó en un horno mufla a 70°C por 12 horas [14].
Las cantidades de los reactivos de hierro se establecieron de acuerdo a la ecuación (1):
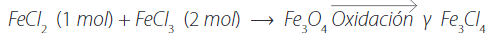 (1)
(1)Para determinar el tamaño de partícula obtenido, se observó bajo un microscopio electrónico (ME) y se analizó en el espectrofotómetro IR donde se precisó su composición.
Síntesis de Grafeno
A partir de 0,625 g polvo de grafito de alta pureza (PGAP), se diluyó en 5 mL de N-metil-2-pirrolidona NMP, luego se sometió a baño ultrasónico por 6 horas.
El grafeno resultante se dividió en cuatro partes iguales, se colocó en los electrodos de las CCMs, y luego se esparció el material a lo largo de la fibra de carbono mediante abrasión hasta obtener una capa uniforme y delgada. Finalmente, se retiró el exceso de material y se almacenó los ánodos en bolsas herméticas. Una de las membranas se observó bajo el Microscopio Electrónico de Barrido (MEB) hasta una amplitud de 5μm.
Análisis de sustratos
Luego de quince días de monitoreo, se secó el sustrato resultante de cada una de las celdas por 24 horas a 105°C, y se colocó 15 mg de cada uno en pequeñas cápsulas de plata.
Las muestras preparadas se analizaron en el Equipo THERMO Combustion Flash 2000 Organic Elemental Analyzer bajo el método C, H, N, S Soil Analizer. Finalmente, los cromatogramas resultantes fueron interpretados por el software Eager 300 EA1112 propio del equipo. La mixtura empleada como sustrato, se analizó antes de su uso en las celdas de combustible bajo el mismo proceso.
Diseño experimental
El diseño de investigación es de un factor con cuatro niveles, evaluado en tres réplicas cada uno, (Tabla 1) y se trabajó con un total de 12 unidades experimentales.
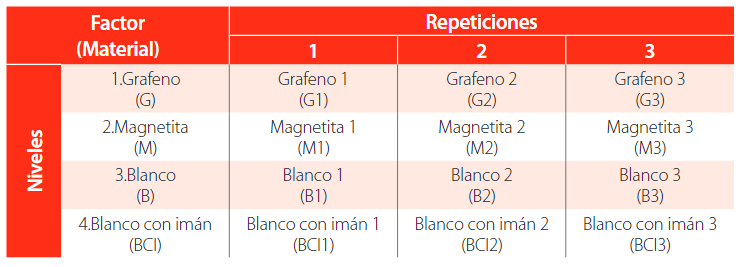
Diseño experimental
Eficiencia
La eficiencia de las CCMs se determinó en base a los niveles de degradación del sustrato y la densidad de potencia producida. Con los valores de voltaje (V) obtenidos a lo largo del monitoreo de las CCMs, se calculó la intensidad de corriente generada a partir de la Ley de Ohm. Ecuación (2):
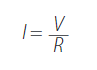 (2)
(2)Donde la resistencia externa (R) considerada fue de 1000 Ω. Una vez obtenidos los valores de intensidad, se determinó la densidad de potencia generada a partir de la ecuación (3):
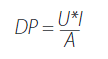 (3)
(3)Donde (U) representa el voltaje generado en voltios, (I) la intensidad de corriente representada en amperios y (A) el área de la membrana de la cámara anódica en m2 Para definir los niveles de degradación del sustrato, se utilizó el equipo THERMO Combustion Flash 2000 Organic Elemental Analyzer, tomando valores antes y después de su paso por las CCMs.
RESULTADOS
Análisis físico-químico del inóculo usado
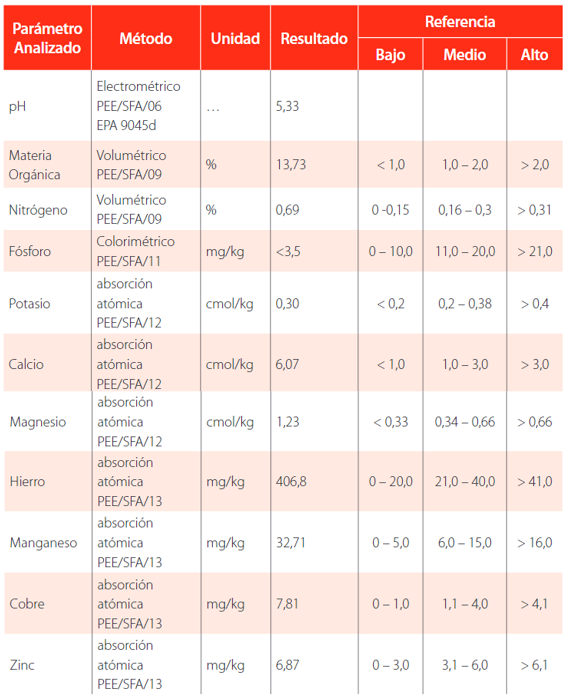
Análisis del inóculo
A partir de estas muestras se analizó la conductividad y porcentaje de humedad dando como resultado 100,1 μS/cm y 77,9% respectivamente.
Materiales sintetizados para la membrana de la cámara anódica
Grafeno
Se obtuvo 0,605 g de grafeno que se observó en el ME, (Figura 4) y el análisis espectroscópico determinó la concentración única de carbono en su composición, (Figura 5).

FIGURA 4.
Presencia de grafeno en la membrana visto en MEB
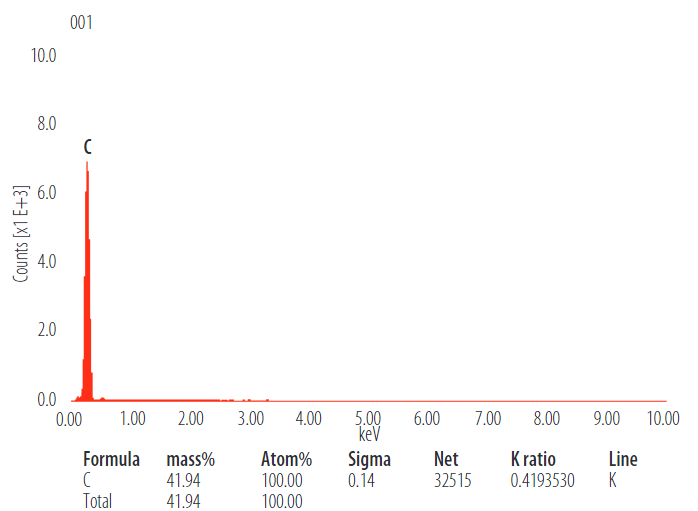
FIGURA 5.
Cromatograma de grafeno
Magnetita
Al final de la síntesis de magnetita se obtuvieron 11,75 g de magnetita; en la Figura 6 6 se aprecia la estructura de este compuesto bajo observación en el MEB, donde las láminas obtenidas son de aproximadamente 20 μm, mientras que en la Figura 7 se aprecia el cromatograma en el cual se indica su composición.

FIGURA 6.
Magnetita vista en MEB
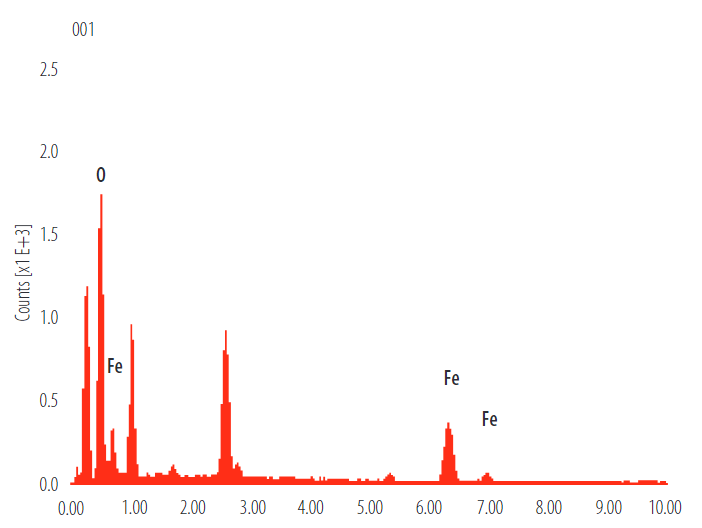
FIGURA 7.
Cromatograma de magnetita
Densidad de Potencia
La Tabla 3, representa la codificación de las CCMs utilizada.
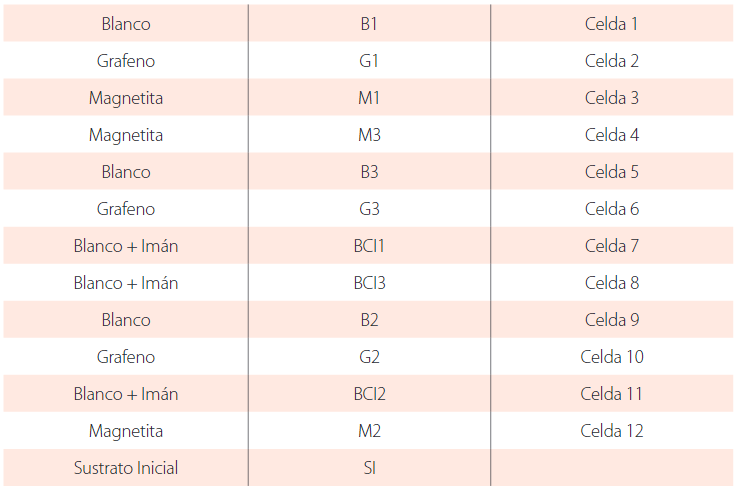
Correspondencia de celdas y tratamientos
Producción de bioelectricidad
La densidad de potencia (DP) se obtuvo mediante la interacción entre voltaje e ingenierías intensidad, relacionadas con el área de la cámara anódica (0,025 m2), de acuerdo a la ecuación (3); la Figura 8 muestra los valores expresados en mW/m2 por cada una de las CCMs por el lapso de 15 días con datos promedios diarios registrados cada minuto.
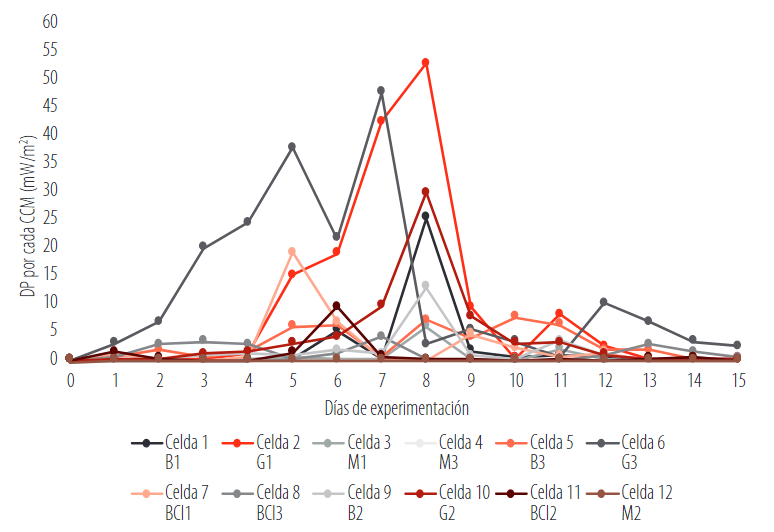
FIGURA 8.
Valores de densidad de potencia
Los valores más altos de densidad de potencia se registran en la celda dos, cuyo pico máximo fue el octavo día con un dato cercano a 52,675 mW/m2; y la celda seis, con su valor máximo de 47,50 mW/m2, el séptimo día de monitoreo.
Las celdas tres, cuatro y doce correspondientes a los tratamientos con magnetita mostraron los valores más bajos de densidad de potencia, y menor producción de bioelectricidad. Sus valores DP máximos son de 5,96 mW/m2, 0,0491 mW/m2 y 0,0518 mW/m2 respectivamente.
Análisis elemental de sustratos empleados
Los análisis se realizaron en el Laboratorio de Protección Ambiental-ESPOCH, usando el Equipo FLASH 2000, los elementos bajo análisis se organizan en la Tabla 4.
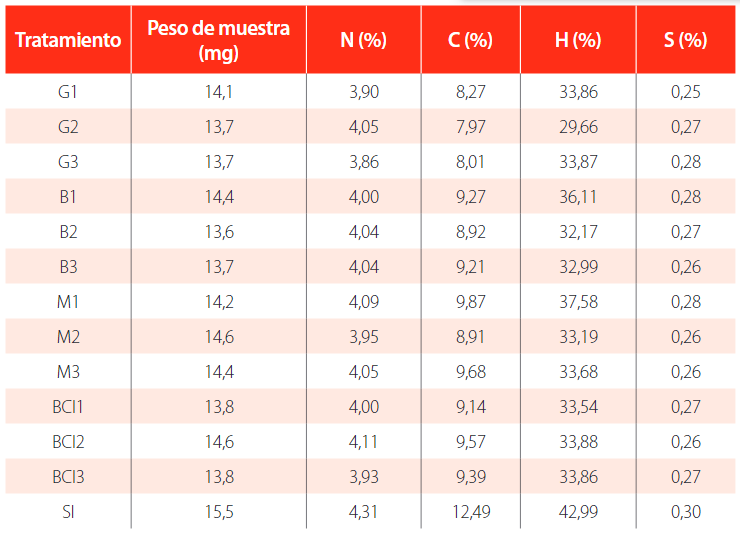
Análisis elemental de sustratos
Comparación de tratamientos
Se usó la prueba no paramétrica de kruskal-wallis, luego de la prueba de normalidad.
Los valores obtenidos se registran en la Tabla 5.
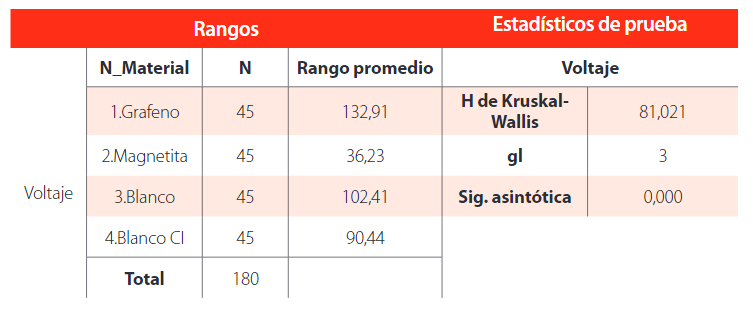
Prueba de kruskal-wallis
Relación entre grafeno y magnetita
Se realizó una comparación por pares usando las pruebas de wilcoxon y mann- whitney con un nivel de significancia de a=0,05, donde al menos una de las medias de los tratamientos de grafeno1, 2 y 3, magnetita 1, 2 y 3 fue a causa de un rendimiento diferente, que se detalla en la Tabla 6.
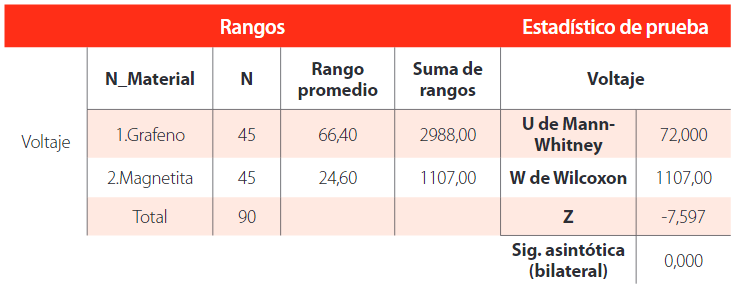
Prueba de suma de rangos Wilcoxon y Mann-Whitney para grafeno y magnetita.
La Figura 9 representa el voltaje obtenido por cada muestra de grafeno, y el grafeno 3 fue el más efectivo para obtener el voltaje; mientras que el tratamiento magnetita 2 y magnetita 3 fueron los menos efectivos.
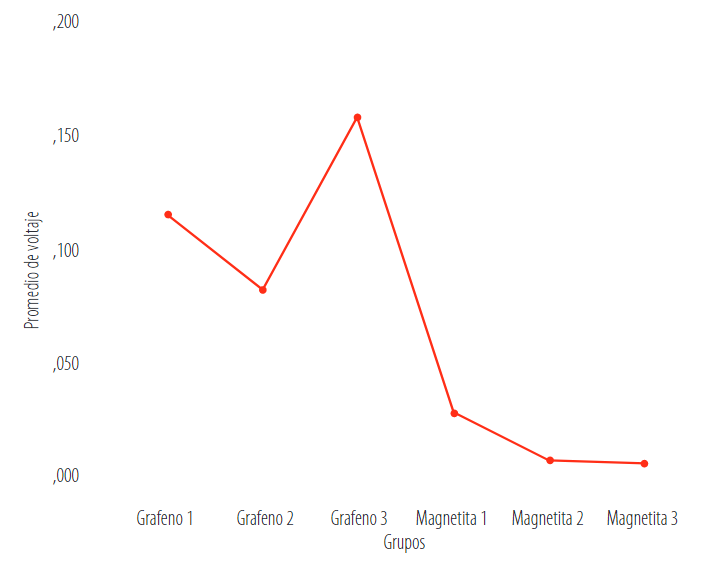
FIGURA 9.
Voltaje promedio generado por los materiales en la membrana
Relación entre grafeno y blanco
El valor de significancia de la prueba de wilcoxon (0,001) muestra que al menos uno de los tratamientos de blanco 1, 2 y 3, grafeno1, 2 y 3 tras el paso del tiempo, fue diferente. Tabla 7
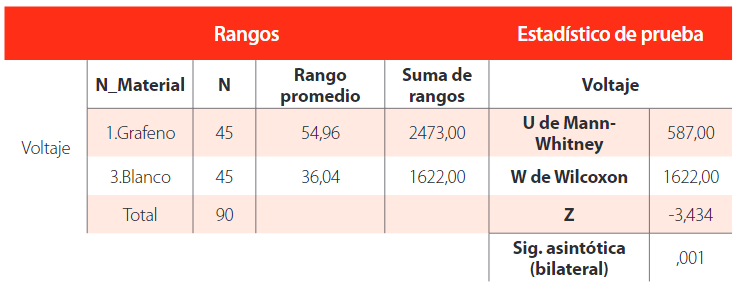
Prueba de suma de rangos Wilcoxon y Mann-Whitney para grafeno y blanco
La muestra de grafeno 3 genera una mayor producción de voltaje y el blanco 1 la menor.
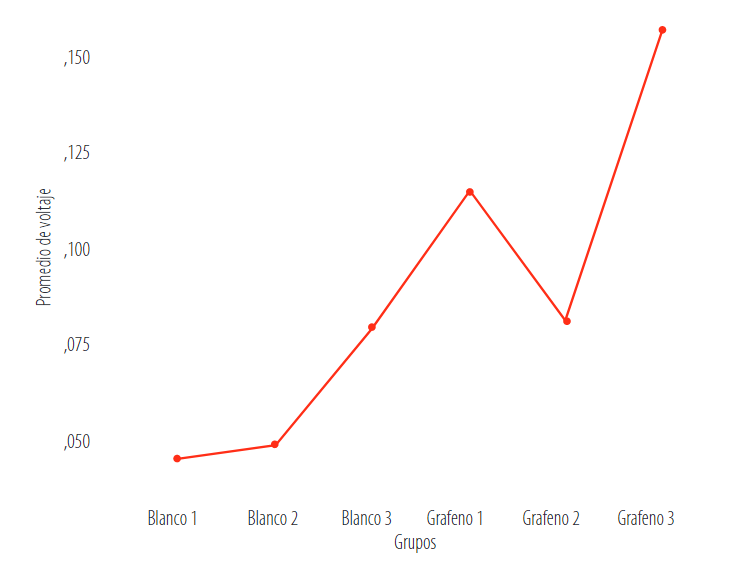
FIGURA 10.
Comparación de medias de tratamientos (grafeno-blanco)
Relación entre grafeno y blanco con imán
El p-valor de la Tabla 8 muestra un nivel inferior a 5, por lo tanto, al menos uno de los tratamientos de blanco con imán 1, 2 y 3, grafeno1, 2 y 3 tras el paso del tiempo, fue diferente.
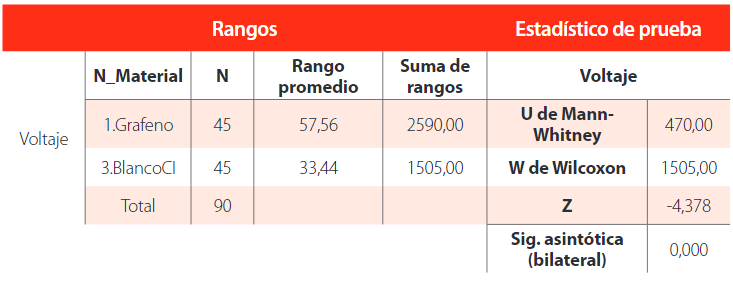
Prueba de suma de rangos Wilcoxon y Mann-Whitney para grafeno y blanco con imán
Relación entre magnetita y blanco con imán
La tabla 9 muestra un p-valor de 0,00 menor a nivel de significancia (0,05), por lo tanto, se menciona que al menos una de las medias de los tratamientos de magnetita 1,2 y 3, blanco con imán1, 2 y 3 fue diferente para obtener el voltaje.
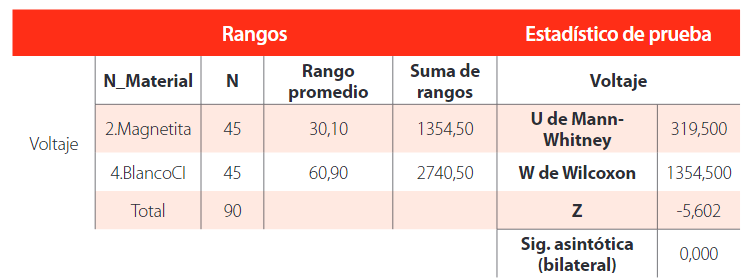
Prueba de suma de rangos Wilcoxon y Mann-Whitney para magnetita y blanco con imán
La Figura 11 muestra que el tratamiento de blanco con imán 1 es el más efectivo para obtener el voltaje; mientras que el tratamiento magnetita 3 presentó resultados inferiores
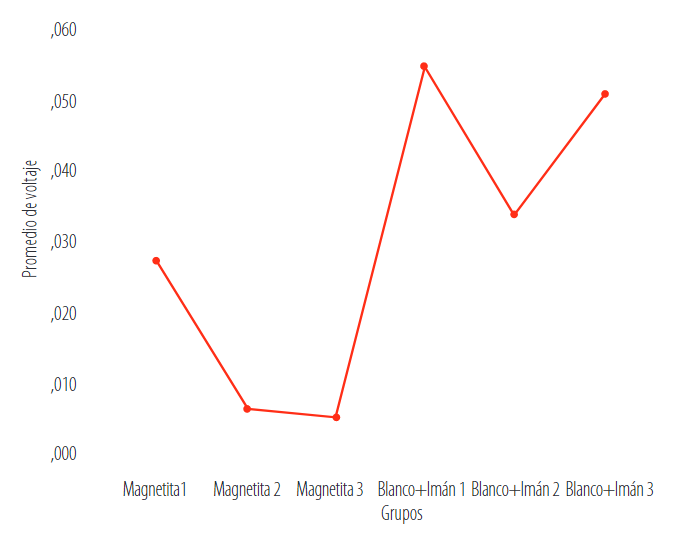
FIGURA 11.
Comparación de medias de tratamientos (magnetita-blanco con imán)
Relación entre magnetita y blanco
Finalmente, la Tabla 10 muestra que al menos una de las medias de los tratamientos de magnetita 1, 2 y 3, blanco 1, 2 y 3 fue diferente para obtener el voltaje.
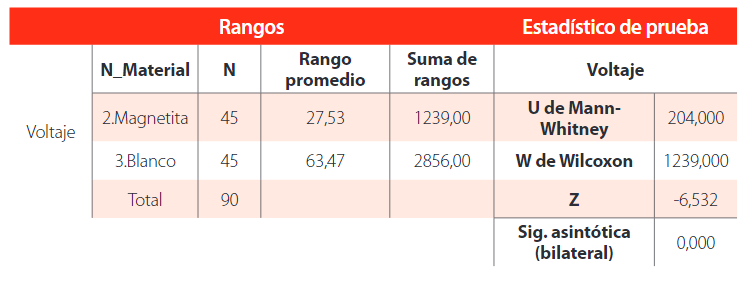
Prueba de suma de rangos Wilcoxon y Mann-Whitney para magnetita y blanco
DISCUSIÓN
Varios estudios se han enfocado en la generación de energía de una celda de combustible microbiano mediante la optimización de las configuraciones del sistema y los materiales [15], con un progreso significativo en los últimos años. Sin embargo, la salida de potencia de una CCM alcanzada, es todavía insuficiente para una aplicación práctica. Por eso, los estudios sobre la recolección de energía todavía se encuentran a escala piloto debido a que la energía de salida es insuficiente para conducir electricidad a aparatos electrónicos que funcionan con corriente directa.
En el presente estudio, la densidad de potencia media de las celdas donde se utilizó la membrana de grafeno fue de 9,18 mW/m2 y un voltaje promedio de 131 mV, representando resultados alentadores comparables a otros estudios [16].
El rendimiento de una CCM está determinado en términos de eficiencia de tratamiento y producción de electricidad, el propósito para la operación de las celdas es siempre obtener valores altos para ambos parámetros, sin embargo, este propósito es complicado alcanzar, porque si bien la eficacia del tratamiento depende de la población total de los microorganismos, la producción de electricidad depende solo del porcentaje de microorganismos electrogénicos dentro de esta población total. Estos microorganismos electrogénicos están en competencia directa con microorganismos anaerobios facultativos y un aumento del volumen de la celda no siempre puede tener un efecto positivo sobre su predominio [3]. De hecho, la formación de biopelículas de microorganismos electrogénicos en la superficie del ánodo; considerando que es el sitio donde ocurre un auge y transporte de electrones; puede verse afectado negativamente por esta competencia, especialmente si los microorganismos contenidos en la materia orgánica triunfan en la pugna por el sustrato. Como se muestra en la Figura 12, los valores de voltaje producidos por cada uno de los tratamientos, considerando que no existió ciclos de alimentación en el transcurso del experimento, llevando a cabo una alimentación a modo Bach, se puede establecer el cumplimiento sobre la relación entre la degradación de sustratos y producción de voltaje [17].
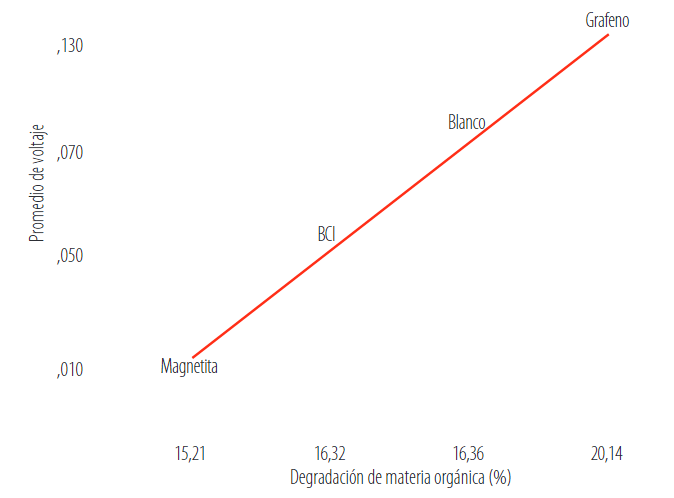
FIGURA 12.
Voltaje en función de la degradación
Como era de esperar, las tasas de eliminación de materia orgánica y la producción de voltaje muestran un mismo comportamiento. Los materiales sobreexpuestos sobre el compartimento anódico indican una mayor producción de voltaje. En el caso de grafeno, una degradación mayoritaria de la materia orgánica en comparación a sus grupos control. En la cámara anódica; de las celdas en las que se añadió grafeno presentaron una densidad de potencia 3,8 veces mayor a las que no poseían este material [9].
Las doce pruebas muestran las mismas tendencias con un aumento en el voltaje de salida desde la etapa de inicio hasta un estado estable y de declinación, esta fluctuación es característica de los procesos biológicos y puede ser explicada de acuerdo a un efecto de crecimiento microbiano donde se puede apreciar que la fase de latencia duró aproximadamente 4 días en donde las celdas tuvieron un crecimiento discreto en su mayoría, para luego de esto experimentar una fase exponencial donde los picos máximos alcanzados fluctuaban entre los 7 y 10 días de monitoreo, posterior, se evidenció una ligera etapa estacionaria de hasta 2 días de duración, para luego descender abruptamente con valores de voltaje cercanos a cero, marcando así presumiblemente la fase de muerte celular.
Cuando las CCMs con grafeno generaba una densidad de potencia de salida máxima de 52,67 mW/m2: sus parámetros químicos mostraban una reducción promedio de 8,60% de N, 35,29% de C, 24,49% de H y 12,16% de S. La tasa de consumo promedio para las CCMs de magnetita fue de 6,44% de N, 24,05% de C, 19,02% de H y 11,35% de S; mientras que su densidad de potencia en su máxima expresión presentaba valores de 5,96 mW/ m2. Al comparar las diferentes pruebas, hay una clara influencia del compartimento anódico en el caso donde se utilizó grafeno tanto para una eficiencia de tratamiento y producción de bioelectricidad.
Hay diferencias entre la celda operada con grafeno con respecto a la magnetita en relación a sus biomoléculas de sustratos analizadas entre que se aprecia una mayor degradación de C, H, N, S, sugiriendo un papel muy importante de los microorganismos fijados en el compartimento anódico. Por otra parte, la síntesis de las nanopartículas de magnetita, sin una adecuada purificación, conlleva a la presencia de ácidos en su estructura lo que afecta al desarrollo del inoculo bacteriano en la cámara anódica, además que acidifica el medio [6].
Este concepto de electronegatividad por parte de los elementos analizados a nivel de traza por cada uno de los tratamientos propuestos es útil para discernir en una estructura que en ciertas regiones son posiblemente más ricas en electrones, a razón de mencionar que compuesto es significativamente iónico o no y en este caso en especial determinar si el requerimiento nutricional fue el más adecuado.
Se encontró que la fracción de C, H, N, S consumida por los microorganismos electrogénicos disminuyen 35,29, 24,49, 8,60 y 12,16% respectivamente en las pruebas con grafeno. Esto claramente indica una mayor población asociada al electrodo de superficie promovida por el uso del material esparcido como tal en el que otros organismos puedan competir por el sustrato. Es importante señalar que la prueba realizada con grafeno da un mejor rendimiento que la prueba realizada con la magnetita, una baja carga de N y S conduce a un aumento significativo de densidad de potencia, además que las densidades máximas de potencia de grafeno fueron 42 veces más altas que la alcanzada con magnetita.
Por lo tanto, los resultados mostrados demuestran que hay una clara influencia del material espolvoreado en la membrana anódica en la producción de electricidad y en el consumo de sus elementos químicos más básicos. De esta manera se asemeja a lo mencionado en estudios donde resalta la biocompatibilidad del grafeno con las celdas de combustible microbiano y la facilidad de descomposición del sustrato [18].
Según investigaciones la mayor degradación de sustratos en este tipo de condiciones puede darse bajo una relación C/N menor a 2,8 [19], lo que contrasta con otros estudios donde se determina una degradación cercana al 60% con una relación C/N de 31,4 [20]. Por otra parte, en este estudio, todas las celdas fueron inicialmente constituidas con una relación C/N de 2,89.
CONCLUSIONES
La membrana de intercambio de la cámara anódica con grafeno añadido presenta una densidad de potencia 42 veces mayor que la obtenida con su similar de magnetita, por su parte la degradación de los sustratos es 1,34 veces superior en las celdas con el material compuesto de carbono en relación al material obtenido a partir de óxidos de hierro.
Se encontró mayores niveles de voltaje en celdas con membranas de grafeno en relación a las de magnetita, por lo tanto, se comprueba un mayor rendimiento de grafeno contrastado con magnetita como membranas de intercambio de electrones. Las celdas de combustible microbianas que poseían grafeno añadido en la membrana de la cámara anódica produjeron mayor cantidad de voltaje promedio (131 mV ), lo que incurrió también en valores superiores de densidad de potencia (9,17 mW/m2), además lograron una mejor degradación de los sustratos a comparación de las celdas que presentaron magnetita en el bioánodo, las cuales, además, mostraron una inferior generación de voltaje (14 mV ) por consecuencia su densidad de potencia también fue menor cercana a 0,22 mW/m2.
El voltaje producido por las CCMs se incrementó a medida que la degradación de los sustratos fue mayor, aproximadamente 14 mV por cada punto porcentual de degradación, por ende, la remoción de la mezcla 50:50 (frutas-verduras) a causa de los microorganismos electrogénicos presentes en el interior de la cámara anódica, permitió la liberación de electrones, los cuales establecieron un flujo a través de las membranas de las estructuras de las celdas dando paso a la transformación electroquímica de material orgánico a bioelectricidad.
AGRADECIMIENTOS
Los autores agradecen el apoyo a esta investigación, a los Técnicos Investigadores de los laboratorios de Biotecnología y Protección Ambiental de la Facultad de Ciencias y en especial al Sr. Miguel Ángel Pérez por el desarrollo e implementación de esta propuesta reflejada en su Trabajo de Titulación, guiada por el Grupo de Investigación GIDAC de la Escuela Superior Politécnica de Chimborazo.
CONTRIBUCIÓN DE LOS AUTORES
Magdy Echeverría: revisión crítica del contenido y validación del diseño del experimento aplicado. Cristina Calderón: redacción y revisión crítica del contenido intelectual del manuscrito. Alex Guambo: mentalizador de la investigación, diseñador del experimento, gestor en la adquisición de los datos estadísticos y redactor del manuscrito.
CONFLICTO DE INTERÉS
Los autores declaran que esta investigación fue conducida en la ausencia de relaciones comerciales o financieras que pudieran constituir un potencial conflicto de interés.
REFERENCIAS
[1] Jiang, Y., Liang, P., Zhang, C., Bian, Y., Sun, X., Zhang, H., ... Huang, X. (2016). Periodic polarity reversal for stabilizing the pH in two-chamber microbial electrolysis cells. Applied Energy, 165, 670–675. doi: https://doi.org/10.1016/j.apenergy.2016.01.001
[2] Park, J.-D., & Ren, Z. (2011). Efficient energy harvester for microbial fuel cells using DC/DC converters. In 2011 IEEE Energy Conversion Congress and Exposition (pp. 3852-3858). IEEE. doi: https://doi.org/10.1109/ECCE.2011.6064292
[3] Logroño, W. N., Echeverría, M. M., Recalde, C. G., & Graziani, P. (2015). Bioconversion of organic solid wastes with soils from the Amazonian and high Andean regions of Ecuador in single chamber microbial fuel cells | Bioconversión de residuos sólidos orgánicos con suelos de la región Amazónica y alto andina del Ecuador en celd. Informacion Tecnologica, 26(2), 61-68. doi: https://doi.org/10.4067/S0718-07642015000200008
[4] Logroño, W., Guambo, A., Pérez, M., Kadier, A., & Recalde, C. (2016). A terrestrial single chamber microbial fuel cell-based biosensor for biochemical oxygen demand of synthetic ricewashed wastewater. Sensors, 16(1), 101. doi: https://doi.org/10.3390/s16010101
[5] Rabaey, K., & Verstraete, W. (2005). Microbial fuel cells: Novel biotechnology for energy generation. Trends in Biotechnology, 23(6), 291-298. doi: https://doi.org/10.1016/j.tibtech.2005.04.008
[6] Nakamura, R., Kai, F., Okamoto, A., Newton, G., & Hashimoto, K. (2009). Self-Constructed Electrically Conductive Bacterial Networks. Angewandte Chemie International Edition, 48(3), 508-511. doi: https://doi.org/10.1002/anie.200804750
[7] Gámez, E. (2016). Evaluación De La Eficiencia De Operación De Una Celda Microbiana De Biocombustible Utilizando Sistemas Electrónicos. UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO. Retrieved from http://www.ptolomeo.unam.mx:8080/jspui/bitstream/132.248.52.100/9981/3/Tesis.pdf%0Ahttp://www.ptolomeo.unam.mx:8080/xmlui/bitstream/handle/132.248.52.100/9981/Tesis.pdf?sequence=3
[8] Lovley, D. R. (2008). Extracellular electron transfer: wires, capacitors, iron lungs, and more. Geobiology, 6(3), 225-231. doi: https://doi.org/10.1111/j.1472-4669.2008.00148.x
[9] Sun, H., Xu, S., Zhuang, G., & Zhuang, X. (2016). Performance and recent improvement in microbial fuel cells for simultaneous carbon and nitrogen removal: A review. Journal of Environmental Sciences, 39, 242-248. doi: https://doi.org/10.1016/j.jes.2015.12.006
[10] Revelo, D. M., Hurtado, N. H., & Ruiz, J. O. (2013). Celdas de Combustible Microbianas (CCMs): Un Reto para la Remoción de Materia Orgánica y la Generación de Energía Eléctrica. Información Tecnológica, 24(6), 7-8. doi: https://doi.org/10.4067/S0718-07642013000600004
[11] Logroño, W., Ramírez, G., Recalde, C., Echeverría, M., & Cunachi, A. (2015). Bioelectricity generation from vegetables and fruits wastes by using single chamber microbial fuel cells with high Andean soils. Energy Procedia, 75, 2009-2014. doi: https://doi.org/10.1016/j.egypro.2015.07.259
[12] Feng, Y., Yang, Q., Wang, X., & Logan, B. E. (2010). Treatment of carbon fiber brush anodes for improving power generation in air-cathode microbial fuel cells. Journal of Power Sources, 195(7), 1841-1844. doi: https://doi.org/10.1016/J.JPOWSOUR.2009.10.030
[13] Rivera Hernández, J. Rosario, & Lomelí Soto, Juana María, & Reyes Palomino, Adolfo, & Cruz Velásquez, Juan José (2003). Obtención a nivel laboratorio de cloruro ferroso a partir de residuos de hierro. Conciencia Tecnológica, (23), ISSN: 1405-5597. Disponible en: https://www.redalyc.org/articulo.oa?id=94402304
[14] Liu, P., Liang, P., Jiang, Y., Hao, W., Miao, B., Wang, D., & Huang, X. (2018). Stimulated electron transfer inside electroactive biofilm by magnetite for increased performance microbial fuel cell. Applied Energy, 216(January), 382-388. https://doi.org/10.1016/j.apenergy.2018.01.073
[15] Franks, A. E., & Nevin, K. P. (2010). Microbial fuel cells, a current review. Energies, 3(5), 899-919. doi: https://doi.org/10.3390/en3050899
[16] Yu, F., Wang, C., & Ma, J. (2018). Capacitance-enhanced 3D graphene anode for microbial fuel cell with longtime electricity generation stability. Electrochimica Acta, 259, 1059-1067. doi: https://doi.org/10.1016/j.electacta.2017.11.038
[17] Rahimnejad, M., Adhami, A., Darvari, S., Zirepour, A., & Oh, S.-E. (2015). Microbial fuel cell as new technology for bioelectricity generation: A review. Alexandria Engineering Journal, 54(3), 745–756. doi: https://doi.org/10.1016/J.AEJ.2015.03.031
[18] Guo, K., Soeriyadi, A. H., Feng, H., Prévoteau, A., Patil, S. A., Gooding, J. J., & Rabaey, K. (2015). Heat-treated stainless steel felt as scalable anode material for bioelectrochemical systems. Bioresource Technology, 195, 46-50. doi: https://doi.org/10.1016/j.biortech.2015.06.060
[19] Kuroda, M., Watanabe, T., & Umedu, Y. (1996). Simultaneous oxidation and reduction treatments of polluted water by a bio-electro reactor. Water Science and Technology, 34(9), 101-108. doi: https://doi.org/10.1016/S0273-1223(96)00792-5
[20] Wang, C.-T., Lee, Y.-C., Liao, F.-Y., Wang, C.-T., Lee, Y.-C., & Liao, F.-Y. (2015). Effect of Composting Parameters on the Power Performance of Solid Microbial Fuel Cells. Sustainability, 7(9), 12634-12643. doi: https://doi.org/10.3390/su70912634