Evaluación fenotípica de dos generaciones de plantas de arveja (Pisum sativum L.) provenientes de semillas irradiadas con rayos gamma
Phenotypic evaluation of two generations of pea plants (Pisum sativum L.) from gamma-irradiated seeds
ACI Avances en Ciencias e Ingenierías
Recepción: 06 Agosto 2020
Aprobación: 02 Noviembre 2020
Publicación: 01 Abril 2021
Resumen: La inducción de mutaciones es una técnica que permite generar nueva variabilidad genética útil para la búsqueda de mutantes de interés en diversos caracteres, para lo cual se pueden utilizar agentes mutagénicos que pueden ser de tipo físico o químico. El objetivo de este estudio fue: evaluar fenotípicamente dos generaciones de plantas provenientes de semillas irradiadas con cobalto 60 de la variedad de arveja INIAP 436 Liliana. La investigación se realizó en la Estación Experimental Santa Catalina (EESC) del INIAP a 3057 msnm y en el Instituto Técnico Superior Simón Rodríguez (ITSSR) a 2775 msnm. La primera etapa consistió en determinar la dosis óptima de radiación para inducir mutaciones (dosimetría). Se probaron cinco tratamientos: 0, 50, 100, 150 y 200 Gy, y se determinó que la dosis óptima fue de 120 Gy. En la segunda etapa se irradiaron 30 000 semillas de arveja de la variedad INIAP 436 Liliana a la dosis determinada. Esta población(M1) fue sembrada en campo junto a un testigo sin irradiar y se evaluó el porcentaje de emergencia y el número de plantas que presentaron sectores mutantes clorofílicos en el cuarto, quinto y sexto foliolo, y plantas que tenían vainas con y sin grano. En la tercera etapa, 50000 semillas de la población M2 fueron sembradas en cada localidad, se midieron las mismas variables que en la etapa anterior. Además, se calculó la frecuencia, efectividad y eficacia de la radiación. En la población M1 tratada se observó disminución en el porcentaje de emergencia, así como el aparecimiento de plantas quiméricas deficientes en clorofila y estériles, lo cual se debe a los cambios genéticos debido a la radiación aplicada. Igualmente, en la M2 se observaron plantas mutantes clorofílicas de las categorías albina, xantha y viridis, lo cual indica que, a pesar de la frecuencia de mutación baja (0,22%), el tratamiento aplicado indujo mutaciones que pasaron a la segunda generación (M2). No fue posible identificar mutaciones que confieran resistencia a Ascochyta sp, debido posiblemente a que es un carácter poligénico.
Palabras clave: Mejoramiento genético, Mutaciones, Mutantes clorofílicas, Progenie.
Abstract: Mutation plant breeding is a technique that generates new genetic variability that can be used to identify and select mutants of interest for various characters. The mutant agent can be physical or chemical. The objective of this study was to evaluate two generations of plants of the pea variety INIAP 436 Liliana whose seed was irradiated with cobalt 60. The research was carried out at the Santa Catalina Experimental Station (EESC) of INIAP at 3057 masl and at the Simon Rodriguez Higher Technical Institute (ITSSR) at 2775 masl. Previously, the optimal dose of radiation to induce mutations (dosimetry) in the pea variety was evaluated with five treatments: 0, 50, 100, 150 and 200 Gy, and it was determined that the optimal dose was 120 Gy. With the optimal dose, 30000 seeds of pea were irradiated. This population (M1) was sown in the field together with a control without irradiation. The emergence percentage and the number of plants that presented chlorophyll mutant sectors in the fourth, fifth and sixth leaflets, and plants that had pods with and without grain were evaluated. In the next cycle, 50000 seeds of the M2 population were sown in each locality, the same variations were measured as in the previous stage. In addition, the frequency, effectiveness and efficiency of the mutation were calculated. In the treated M1 population, a decrease in the percentage of emergence was observed, as well as the appearance of chimeric plants deficient in chlorophyll and sterile, which is due to genetic changes due to the applied radiation. Similarly, in M2 chlorophyll mutant plants of the albino, xantha and viridis categories were observed, which indicates that, despite the low mutation frequency (0.22%), the applied treatment induced mutations that passed to the second generation (M2). It was not possible to identify mutations that confer resistance to Ascochyta sp, possibly due to its polygenic character.
Keywords: Chlorophyll mutants, Mutations, Plant breeding, Progeny.
INTRODUCCIÓN
La inducción de mutaciones es una técnica que permite generar nueva variabilidad genética. Se realiza empleando agentes mutagénicos que pueden ser de tipo físico o químico [1]. En el grupo de los agentes físicos se encuentran los rayos gamma que son emitidos por los radionucleidos cobalto 60 (60Co) o cesio ( 137Cs) y que son un tipo de radiación electromagnética, ionizante y muy penetrante [2]. La exposición de células vivas a estos rayos ocasionan estrés oxidativo que conlleva daños al ADN, entre otras macromoléculas. La reparación enzimática de tales daños puede producir mutaciones [3, 4]. La dosis óptima del agente mutagénico es aquella que produce alteraciones en el ADN sin comprometer en gran medida la viabilidad del material tratado. Para determinarla, se debe medir el efecto de la exposición a un rango de dosis sobre variables como altura o peso seco de plántulas [5]. La dosis óptima es aquella que ocasiona una reducción del 30% en la variable evaluada [6].
Para inducir mutaciones en leguminosas se recomienda utilizar los rayos gamma e irradiar de 5000 a 10000 semillas, que forman la generación . Las semillas cosechadas a partir de esas plantas originan la generación , que debe estar formada por al menos 50000 individuos. Las plantas son quiméricas. Esta característica se observa fácilmente debido al aparecimiento de sectores mutantes clorofílicos. En la , salvo excepciones [7], no existen quimeras y se observan plantas mutantes clorofílicas con la totalidad de sus tejidos de un color diferente al usual, pudiendo pertenecer a las categorías albina (blanca, sin clorofila), xantha (amarilla) y viridis (verde claro) [6]. El registro del número de plantas mutantes clorofílicas es útil para calcular la frecuencia de mutaciones inducida por el tratamiento mutagénico, así como su efectividad y eficiencia. La efectividad se define como una medida de la frecuencia de mutaciones inducidas por unidad de agente utilizado. La eficiencia provee la proporción de mutaciones en relación con otros efectos biológicos deletéreos observables en la , tales como letalidad, esterilidad del polen y aberraciones cromosómicas [8].
Es recomendable que en fitomejoramiento mediante mutagénesis se emplee una variedad ya liberada, en la cual la mejora de una o dos características incrementen su valor agronómico. La variedad de arveja INIAP 436 Liliana, de tipo decumbente, posee buenas características agronómicas, tales como: precocidad intermedia, buen vigor de crecimiento, grano grande, buena demanda en el mercado y aptitud para elaboración de harina; sin embargo, es susceptible a ascoquitosis [9].
Con la finalidad de evaluar fenotípicamente dos generaciones de plantas provenientes de semillas irradiadas de la variedad de arveja INIAP 436 Liliana, se indujeron mutaciones empleando rayos gamma. El proceso se dividió en tres etapas. En la primera etapa (dosimetría), se determinó la dosis óptima en base a la reducción producida por la radiación en la altura promedio de plántulas. La segunda etapa, correspondió a la evaluación en campo de una población testigo y una población irradiada a la dosis óptima (generación ). Se midieron los porcentajes de emergencia, porcentajes de plantas con sectores mutantes clorofílicos y porcentajes de plantas que llegaron a producir semillas en cada población. En la tercera etapa (generación ), se determinó los porcentajes de emergencia, la frecuencia de mutaciones clorofílicas y se evalúo la resistencia a Ascochyta spp, de la población irradiada y el testigo.
MATERIALES Y MÉTODOS
La investigación se realizó en la Estación Experimental Santa Catalina (EESC) del INIAP y en el Instituto Técnico Superior “Simón Rodríguez” (ITSSR), Ecuador. La primera está ubicada en la parroquia Cutuglahua del cantón Mejía, provincia de Pichincha, a una altitud 3057 msnm, con temperatura promedio de 11.6°C, nivel de precipitación de 1400 mm anuales y humedad relativa de 79%. El ITSSR se localiza en la parroquia Aláquez del cantón Latacunga en la provincia de Cotopaxi, a una altitud de 2775 msnm con una temperatura promedio de 14.5 °C, nivel de precipitación de 500 mm anuales y humedad relativa del 70% [10].
Las irradiaciones se realizaron en las instalaciones de la Subsecretaría de Control, Investigación y Aplicaciones Nucleares del Ministerio de Electricidad y Energía Renovable; las mismas están ubicadas en la localidad de Aychapicho del cantón Mejía, provincia de Pichincha, Ecuador.
Etapa I. Dosimetría
Se determinó el porcentaje de humedad de semillas de arveja de la variedad INIAP 436 Liliana empleando un medidor de granos Steinlite (Fred Stein Laboratories, Inc.). Las semillas se irradiaron con una fuente de cobalto 60 (irradiador modelo 109-68, J.L. Sheperd and Associates Inc.). Se probaron cinco tratamientos: 0, 50, 100, 150 y 200 Gy. Se irradiaron 500 semillas para cada tratamiento. Después se desinfectaron con una solución de hipoclorito de sodio al 10%, en la cual se sumergieron durante 10 minutos, seguido de lo cual se enjuagaron tres veces con agua destilada estéril.
Se realizaron tres pruebas. Para cada prueba se destinaron 150 semillas por tratamiento, y cada tratamiento estuvo formado por tres repeticiones de 50 semillas cada una. En la primera prueba se midió el efecto de los tratamientos sobre la variable “porcentaje de germinación”. Para esto, las semillas se mantuvieron sobre toallas de papel absorbente reutilizable humedecidas con agua destilada estéril, dentro de una estufa a 20°C durante nueve días, al cabo de los cuales se contabilizó el número de semillas germinadas.
En la segunda prueba se midió la supervivencia de las plantas hasta los 31 días posteriores a la siembra. Las semillas se sembraron sobre un sustrato constituido por tierra, compost, cascarilla de arroz y piedra pómez en una proporción de 4:2:1:1. Este sustrato se esterilizó en una autoclave a 121°C, durante 40 minutos. El riego se realizó con agua estéril. Una vez transcurrido el tiempo establecido, se contabilizó el número de plantas que aún se desarrollaban en cada unidad experimental.
En la tercera prueba, se midió la altura promedio que alcanzaron las plántulas hasta el punto de inserción del segundo foliolo. Para cada repetición se realizó el siguiente procedimiento: las semillas se colocaron cerca del borde de una toalla de papel humedecida con agua estéril. Entre cada semilla se ubicó una pajilla plástica. La toalla, junto con las semillas y las pajillas se envolvieron alrededor de un tubo de PVC de 25 cm de largo y 2.54 cm de diámetro y se sujetaron al mismo con ligas de hule. Este paquete se introdujo en un vaso plástico desechable de 1 l de capacidad. Se regaron las plántulas dos veces al día con agua estéril, y al cabo de un mes se realizaron las mediciones respectivas.
Una vez conocidas las alturas promedio de las plántulas por cada tratamiento, se determinó la ecuación y la curva de regresión para las dosis de radiación utilizando el programa Microsoft Excel. En base a la ecuación se calculó la dosis de radiación que produciría una reducción del 30% en la altura de las plántulas.
Etapa II. Generación M1
Se irradiaron con la fuente de cobalto 60, 30000 semillas de arveja de la variedad INIAP 436 Liliana con un porcentaje de humedad del 12.7% a la dosis óptima previamente determinada. Estas semillas se sembraron en el ITSSR en surcos de 75 m de largo con un espaciamiento entre sitios de siembra de 10 cm y entre surcos de 80 cm. Entre los surcos de la población irradiada se sembraron surcos con semillas testigo o control.
A los 19 días de la siembra, se midió en surcos seleccionados al azar el porcentaje de emergencia en la población irradiada y el testigo. En la muestra de cada población se contabilizó el número de plantas emergidas, se lo dividió por el número estimado de semillas sembradas y se multiplicó este resultado por 100.
A los 38 días, se seleccionaron al azar dos surcos de la población irradiada y de la población testigo. En cada muestra se contabilizó el número de plantas que presentaron sectores mutantes clorofílicos en el cuarto, quinto y sexto foliolo. Se contabilizó también el número total de plantas evaluadas en cada muestra. Con esta información, se calculó el porcentaje de presencia de sectores mutantes para cada foliolo considerado.
A los 136 días, se seleccionaron 100 plantas al azar de cada una de las dos poblaciones. Se contabilizó el número de plantas que tenían vainas con granos, así como aquellas que presentaban vainas vacías. La cosecha se efectuó a los 145 días. Se cosecharon 8 vainas provenientes del tallo principal de cada planta.
Etapa III. Generación M2
Las semillas cosechadas en la etapa anterior se sembraron en dos localidades, en la EESC y en el ITSSR. En cada localidad se sembraron más de 50000 semillas provenientes de cuatro vainas de cada planta M1. Adicionalmente, se sembraron semillas testigo en surcos distribuidos entre la población irradiada.
Localidad EESC
El espaciamiento entre plantas y surcos fue el mismo que el empleado en la etapa 2. La longitud de los surcos fue de 100 m en la EESC. La medición de los porcentajes de emergencia se efectuó tres semanas después de la siembra. Se seleccionaron al azar 10 surcos de la población irradiada y 3 surcos de la población testigo. Se aplicó el mismo procedimiento realizado en la etapa 2 para obtener los porcentajes de emergencia. En forma simultánea, se contabilizó las plantas mutantes clorofílicas y se las clasificó en las categorías albina, xantha y viridis. Con esta información se calculó la frecuencia de mutación inducida utilizando la fórmula [6]:
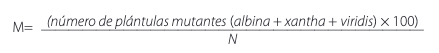
GHF
GHHG
GHFG
GHHGFGEn donde: M = frecuencia de mutación como porcentaje. N = número de todas las plántulas analizadas para una dosis particular. Para estimar la cantidad total de plántulas evaluadas dentro de la población, se promedió el número de plántulas presentes dentro de los surcos muestreados y a este valor se le multiplicó por el número total de surcos sembrados.
A los 96 días después de la siembra, se realizó la inoculación de las plantas con un aislamiento de Ascochyta sp. proveniente de la EESC. La concentración empleada fue de conidias [11]. La inoculación se realizó empleando una bomba de mochila de 20 l de capacidad. A la solución se le añadió un fijador agrícola a una dosis de 1 ml por litro. Las plantas fueron inoculadas en las últimas horas de la tarde.
Localidad ITSSR
La longitud de los surcos en esta localidad fue de 90 m, el espaciamiento entre plantas y entre surcos fue el mismo que en la EESC. Para determinar los porcentajes de emergencia se seleccionaron 10 surcos al azar de la población irradiada y 5 surcos de la población testigo. Se aplicó el mismo procedimiento empleado en la etapa 2. Una vez conocidos los porcentajes de emergencia de ambas poblaciones en las dos localidades, se realizó la transformación raíz cuadrada del arcoseno para poder realizar el análisis de varianza [10]. Para la obtención de la frecuencia de mutación se siguieron los mismos pasos empleados en la EESC.
La inoculación de Ascochyta sp se realizó a los 106 días de la siembra con un aislamiento proveniente del ITSSR. La concentración de conidias en la solución fue la misma que la utilizada en la EESC, así como los implementos, aditivos y procedimientos realizados. Las evaluaciones de la reacción de las plantas al patógeno se realizaron a los 25 y 46 días después de la inoculación.
Cálculo de la efectividad y la eficiencia del tratamiento mutagenico
La fórmula aplicada para calcular la efectividad de un agente mutagénico físico fue la empleada por Konzak et al., citados por Wani (2009) [12], la cual es:
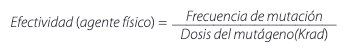
FGFD
FGF
FGF
GFGFHGEn cuanto a la eficiencia de un agente mutagénico, la fórmula que se utilizó para obtenerla fue la siguiente (Konzak et al., citados por Wani (2009) [12]:

TYJY
YUJ
JUY
HFGGRESULTADOS Y DISCUSIÓN
KJK
Etapa I. Dosimetría
Se encontró que las distintas dosis de radiación no tuvieron efecto sobre la capacidad de germinación de las semillas de arveja (Figura 1). Resultados similares fueron obtenidos en trabajos con arveja, vigna y trigo [13, 14, 15].
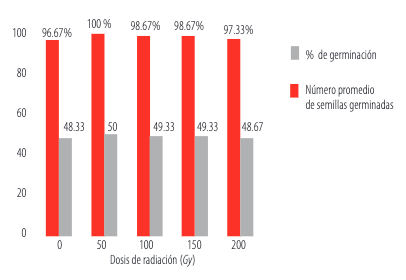
FIGURA 1
GFHH
Número promedio de semillas germinadas y porcentaje de germinación para cada dosis de radiación empleada.
GFFEn la evaluación de la supervivencia a los 30 días, se observó que la dosis de 200 Gy presentó un marcado descenso en el número de plantas que aún continuaban con su desarrollo. La reducción a esta dosis fue del 25.2% (Figura 2). Un resultado similar se observó al irradiar semillas de haba por sobre los 200 Gy [16].
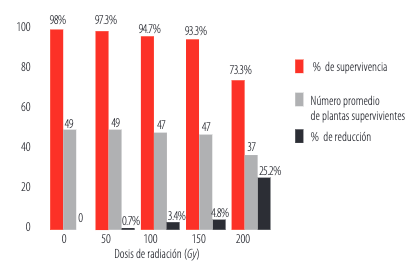
FIGURA 2
FGBFD
Número promedio de plantas supervivientes, porcentaje de supervivencia y porcentaje de reducción con respecto al tratamiento testigo, observados para cada dosis de radiación gamma aplicada.
GFGFDLa altura promedio de las plántulas hasta el punto de inserción del segundo foliolo, se redujo conforme se incrementó la dosis de rayos gamma (Figura 3). Esto puede deberse a que en los meristemas de las plantas irradiadas se presentan tres tipos de cambios citológicos: retraso en el ciclo celular, formación de aberraciones cromosómicas y pérdida de la capacidad proliferativa debido a una diferenciación temprana o a muerte celular. Se sugiere que este último cambio es el principal responsable de la reducción en el crecimiento [17]. En base a esta información se procedió a determinar la dosis óptima de radiación, para lo cual, se determinó la curva y la ecuación de regresión:
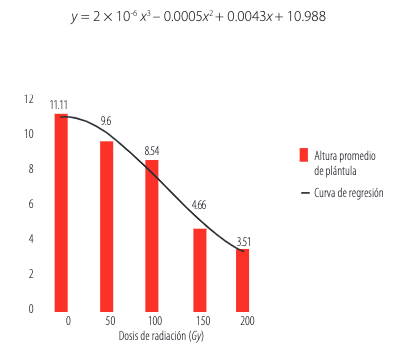
FIGURA 3
FGFDH
Reducción en la altura promedio de las plántulas como efecto de las dosis de radiación aplicadas.
FDGFGDado que la altura promedio de las plántulas en el tratamiento testigo fue de 11.11 cm (Figura 3), la dosis buscada fue aquella que produjese una reducción del 30% , es decir, 7.78 cm. Una vez resuelta la ecuación cúbica, se encontró que la dosis óptima de radiación es de 119.66 Gy, valor que se redondeó a 120 Gy. De acuerdo a diversos trabajos [9 , 10], para inducir mutaciones en semillas de arveja con rayos gamma, el rango de dosis recomendadas se ubica entre los 100 a 150 Gy [6].
Etapa II. Generación M1
Los porcentajes de emergencia observados en la población irradiada y la población testigo fueron diferentes. En la primera la emergencia fue del 31.4% y en la segunda del 65%. Resultados similares se obtuvieron al irradiar semillas de arveja de las variedades “Amarilla” y “Alderman”, con dosis de 140 y 180 Gy de rayos gamma incluyendo poblaciones testigo [18].
Se observaron plantas con sectores mutantes clorofílicos solo en la población irradiada. Pero, el porcentaje de estas alteraciones se redujo en los foliolos más jóvenes de la parte superior de la planta (Tabla 1). La presencia de sectores mutantes clorofílicos en las plantas M1 es un indicio del daño causado por la radiación sobre genes que regulan la capacidad fotosintética de las células vegetales, el cual está regulado por genes presentes tanto en el núcleo como en los cloroplastos [19].
La pérdida de los sectores mutantes clorofílicos conforme se desarrolla la planta se puede explicar mediante los procesos de deriva y selección diplóntica; la primera se debe a las condiciones ambientales como la temperatura y fotoperiodo que afectan la estabilidad de las células en el ápice de una planta. Si una célula mutante es desplazada del ápice, deja de generar tejidos que conforman nuevos órganos y el sector se pierde. Está pérdida se da al azar [20]. La selección diplóntica, consiste en la competencia entre tejidos con diferente genoma dentro de una misma planta. Por lo general los sectores mutantes, al acarrear alteraciones genéticas, pueden estar en desventaja competitiva y, en consecuencia, desaparecer [21]. En otro estudio solamente se encontró evidencia de “selección diplontica” en donde, existen varios meristemas potenciales, de los cuales solo unos pocos pueden desarrollarse. Esto sucede durante la formación de yemas axilares y adventicias [20]. Otra causa para la presencia de un número menor de sectores con pigmentación en hojas de la parte superior de la planta, se debe a que están representadas por un número menor de células en el momento de la irradiación.
El porcentaje de plantas con vainas vacías dentro de la población irradiada fue del 13%, mientras que en la población testigo no se encontraron este tipo de alteraciones. Esto se debería a un daño fisiológico general ocasionado en la semilla, debido a la letalidad de los tratamientos con rayos gamma (Tabla 1). De acuerdo a [22] y [23], posiblemente estas alteraciones también pueden atribuirse a disturbios producidos durante la meiosis.
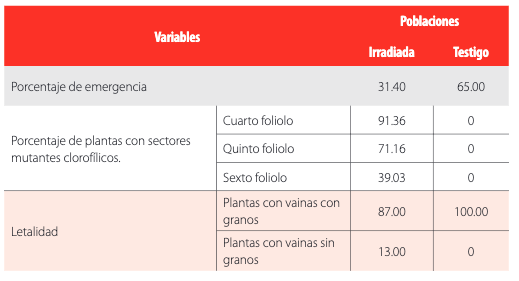
Resultados observados en las variables medidas durante la generación
FDGFTABLA 1 Resultados observados en las variables medidas durante la generaciónEtapa III. Generación M2
Aunque se observaron ligeras diferencias entre los porcentajes de emergencia de la población irradiada y el testigo en las dos localidades (Figura 4), el análisis de varianza realizado con los datos transformados demostró que no existieron diferencias significativas entre los valores observados (Tabla 2).
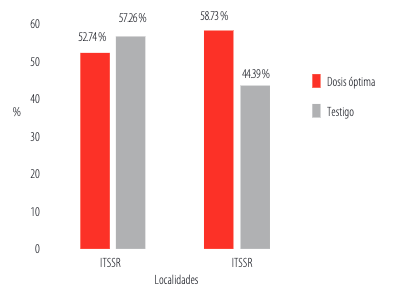
FIGURA 4
TGHT
Porcentajes de emergencia en la Etapa III de las poblaciones “Dosis óptima” y “Testigo” en dos localidades.
GREGG
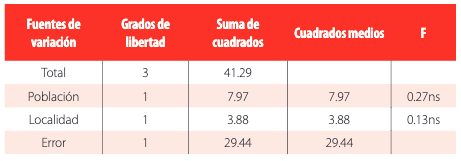
Análisis de varianza de la emergencia de plantas observada en las poblaciones irradiadas y testigo en dos localidades.
GTRGHTTABLA 2 Análisis de varianza de la emergencia de plantas observada en las poblaciones irradiadas y testigo en dos localidades.En la población , se observaron plántulas con sectores mutantes clorofílicos de tipos: Albina, Xantha y Viridis. La frecuencia de mutación de la población irradiada fue de 0.22% en ambas localidades (Tabla 3). Esta frecuencia de mutación también fue observada por otros investigadores en arveja [18]; en dichos trabajos hallaron que en la las frecuencias de mutaciones clorofílicas se encontraban entre 0.20 y 0.35% para dosis de radiación gamma entre 140 y 180 Gy. En contraste a los resultados mencionados, en otros trabajos reportan frecuencias de mutaciones clorofílicas de hasta el 6.27% al irradiar semillas de arveja de las variedades indias DDR-53 y DMR-55 con rayos gamma a dosis de 50, 70 y 100 Gy [8]. El origen de deficiencias clorofílicas en plantas se debe, principalmente, a mutaciones en genes que codifican para la síntesis de pigmentos fotosintéticos o en genes de mitocondria [8]. Es necesario señalar que otros genes que determinan atributos de interés agronómico pueden mutar con menor frecuencia que aquellos que controlan la elaboración de clorofila [6].
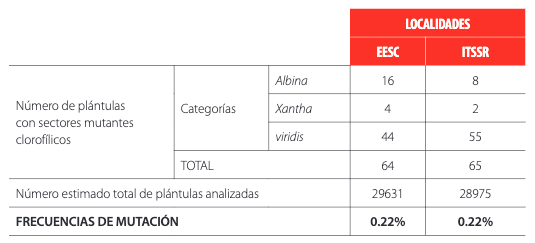
Número de plántulas mutantes clorofílicas observadas dentro de las poblaciones irradiadas en la Generación en cada localidad y sus correspondientes frecuencias de mutación
FGGTABLA 3 Número de plántulas mutantes clorofílicas observadas dentro de las poblaciones irradiadas en la Generación en cada localidad y sus correspondientes frecuencias de mutaciónTodas las plantas fueron susceptibles a Ascochyta sp , debido posiblemente a que la arveja tiene una base genética sumamente compleja y que la resistencia genética puede estar determinada por varios genes y su herencia es cuantitativa [24].
Efectividad y eficiencia del tratamiento mutagénico
Los valores de la efectividad y eficiencia del agente mutagénico aplicada en la variedad Liliana fueron de 0.0018 y 0.0169, respectivamente. Al comparar estos valores con lo observado en las variedades DDR-53 y DDR-55 [8] son sustancialmente superiores a los valores encontrados en la presente investigación; lo cual lleva a indicar que la variedad INIAP Liliana posiblemente posee una radiosensibilidad menor que las variedades indias.
CONCLUSIONES
La dosis óptima para inducir mutaciones en la variedad INIAP 436 Liliana fue de 120 Gy. Esta dosis de rayos gamma originó una disminución del 30% en altura de plántulas comparándola con un tratamiento testigo, sin exposición a radiación.
La presencia de sectores deficientes en clorofila y esterilidad en plantas adultas son indicios de que se produjeron cambios genéticos en la semilla irradiada.
A pesar de que la frecuencia de mutaciones clorofílicas observada en la generación fue baja, el tratamiento con rayos gamma indujo mutaciones que lograron pasar a la segunda generación. Sin embargo, se podría aumentar las dosis pero sin exceder la letalidad.
No fue posible aislar mutaciones en la variedad de arveja INIAP 436 Liliana que confieran resistencia a Ascochyta sp, mediante el uso de rayos gamma a la dosis de 120 Gy debido que esta característica posiblemente es poligénica.
REFERENCIAS
Prina, A., Landau, A., Pacheco, M., & Hopp, E. (2010). Mutagénesis, TILLING y EcoTILLING. In: G. Levitus, V. Echenique, C. Rubinstein, E. Hopp, & L. Mronginski (Edits.), Biotecnología y Mejoramiento Vegetal (Segunda edición ed., pp. 217228). Castelar, Argentina: Argenbio INTA.
Prina, A. R., Pacheco, M. G., Landau, A. M. (2012). Mutation Induction in Cytoplasmic Genomes. In: Shu QS, Foster BP, Nakagawa H (Eds), Plant Mutation Breeding and Biotechnology (pp. 201-206). Rome: FAO-IAEA.
Lagoda, P. (2012). Effects of Radiation on Living Cells and Plants. In: Q. Shu, B. Foster, & H. Nakagawa (Edits.), Plant Mutation Breeding and Biotechnology (pp. 123-133). Vienna: S.L. CABI (Centre for Agriculture Bioscience International). Joint FAO IAEA.
Curtis, M. (2012). DNA Repair Pathways and Genes in Plant. In: Q. Shu, B. Foster, & H. Nakagawa (Edits.), Plant Mutation Breeding and Biotechnology (pp. 57-59). Vienna, Austria: S.L. CABI (Centre for Agriculture Bioscience International). Joint FAO IAEA.
FNCA (Forum for Nuclear Cooperation in Asia). (2004). Mutation Breeding Manual. (F. Medina, E. Amano, & T. S, Edits.)
Maluszynski, M., Szarejko, I., Chittaranjan, B., Nichterlein, K., & Lagoda, P. (2009). Methodologies for generating variability Part 4: Mutation techniques. In: S. Ceccarelli, E. Guimaraes, & E. Weltizien (Edits.), Plant Breeding and Farmer Participation (pp. 160-173). Roma, Italia: FAO.
Prina A. R., Pacheco M. G., Landau A. M. (2012). Mutation Induction in Cytoplasmic Genomes. In: Shu QS, Foster BP, Nakagawa H (Eds). Plant Mutation Breeding and Biotechnology ( ) Rome: FAO-IAEA.
Dhulgande, G., Dhale, D., Pachkore, G., & Satpute, R. (2011). Mutagenic Effectiveness and Efficiency of Gamma Rays and Ethyl Methanesulphonate in Pea (Pisum sativum L.). Journal of Experimental Sciences, 3(2), 7-8.
Peralta, E., Murillo, A., Mazón, N., Monar, C., Pinzón, J., & Rivera, M. (2010). Manual Agrícola de Fréjol y otras Leguminosas. Cultivos, variedades y costos de producción. (Segunda ed.). Quito, Ecuador: Programa Nacional de Leguminosas y Granos Andinos. Estación Experimental Santa Catalina. INIAP.
McDonald, J. (2009). Handbook of Biological Statistics. Recuperado el 20 de enero de 2013, de http://udel.edu/~mcdonald/stattransform.html.
Castellanos, G., Jara, C., & Mosquera, G. (2011). Guías Prácticas de Laboratorio para el Manejo de Patógenos del Frijol. Cali, Colombia: Centro Internacional de Agricultura Tropical (CIAT).
Wani, A. (2009). Mutagenic Effectiveness and Efficiency of Gamma Rays, Ethyl Methane Sulphonate and their combination treatments in Chickpea (Cicer arietinum L.). Asian Journal of Plant Science, 1( 4).
Qftq, Y., Divalin Türkan, A., & Khawar, K. (2006). Use of Gamma Rays to Induce Mutations in four Pea (Pisumsativum L) Cultivars. Turk J Biol, 29-37.
Kon, E., Ahmed, O., Saamin, S., & Majid, N. (2007). Gamma Radiosensitivity Study on Long Bean (Vigna sesquipedalis). Am. J. Applied Sci, 12(4), 1090-1093.
Borzouei, A., Kafi, M., Khazaei, H., Naseriyan, B., & y Majdabadi, A. (2010). Effects of gamma radiation on germination and physiological aspects of wheat (Triticum aestivum L.) seedlings. Pak. J. Bot, 42(4), 2281-2290.
Mejri, S. M., Voisin, M., Delavault, P., Simier, P., Saidi, M., & y Belhadj, O. (2012). Variation in quantitative characters of faba bean after seed irradiation and associated molecular changes. Afr. J. Biotechnol, 11(33).
Evans, H. (1965). Effects of radiations on meristematig cells. Radiation Botany, 5(2), 171-182.
Gómez, L., Torres, M., & Romero, M. (1984). Inducción de mutaciones en arveja (Pisum sativum L.) para la Sierra del Perú. (FAO/IAEA, Ed.) Induced mutations for crop improvement in America, 356.
Taiz, L., & Zeiger, E. (2006). Fisiología Vegetal. Castello de la Plana, España: Publicacions de la Universitat Jaume I.
Balkema, G. (1971). Chimerism and diplontic selection. PhD Tesis Landlouwhogeschool. Wageningen, Holanda
Prina, A., Landau, A., & Pacheco, M. (2012). Chimeras and Mutant Gene Transmission. In. Q. Shu, P. Foster, & H. Nakagawa (Edits.), Plant Mutation Breeding and Biotechnology (pp. 184-188). S.L. CABI (Centre for Agriculture Bioscience International) Joint FAO/IAEA.
Demchenko, S. & Avrutskaya, T. (1979). On the nature of the induced sterility of plants. Arabidopsis information service, (16) 84-88.
Ekberg, I. (1969). Different types of sterility induced in barley by ionizing radiations and chemical mutagens. Hereditas. 63, 255-278.
Timmerman-Vaughan, G., Frew, T., Russell, A., Khan, T. Butler, R., Gilpin, M., Murray, S & Falloon, K. (2002). QTL Mapping of Partial Resistance to Field Epidemics of Ascochyta Blight of Pea. Crop Sci. 42:2100-2111.
Información adicional
CONTRIBUCIONES
DE LOS AUTORES: Ángel Murillo, Eduardo Peralta y Pablo Álvarez
concibieron la investigación; Pablo Álvarez y Ángel Murillo desarrollaron la
metodología y realizaron el trabajo en campo; Pablo Álvarez y Emilio Basantes y
Álvaro Yépez realizaron los análisis estadísticos; Pablo Álvarez y Ángel
Murillo redactaron el manuscrito; Eduardo Peralta, Ángel Murillo, Emilio
Basantes y Álvaro Yépez revisaron críticamente el contenido intelectual del
manuscrito; Ángel Murillo realizó la revisión, corrección y edición final del
manuscrito.