



Estimación del tamaño poblacional y del uso del hábitat de Pristimantis unistrigatus (Gunther, 1859) (Anura: Strabomantidae) en un área verde urbana de Quito - Ecuador
Population size estimation and habitat use of Pristimantis unistrigatus (Gunther, 1859) (Anura: Strabomantidae) in an urban green area from Quito - Ecuador
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
Recepción: 09 Abril 2020
Aprobación: 01 Junio 2022
Resumen:
Las áreas verdes en las grandes ciudades pueden albergar una gran biodiversidad, proveyendo refugio a distintos taxones nativos cuyas dinámicas adaptativas con respectoa los cambios demográficos son interesantes de explorar. Un grupo importante en áreasverdes urbanas son los anfibios, indicadores del estado actual de un ecosistema. Nos enfocamos en la rana Cutín de Quito Pristimantis unistrigatus con el fin de conocer suecología dentro de un área verde de la ciudad. Usamos un método de captura-recapturapor foto-identificación, en noviembre 2015 y enero 2016 en el campus de la UniversidadCentral del Ecuador. Usando el estimador poblacional Petersen, estimamos unapoblación de 1749 individuos y una densidad poblacional de 40 indiviuos por hectárea. La mayoría de los individuos fueron hembras y se encontraron en el estrato herbáceo. Pristimantis unistrigatus mostró ocho patrones morfológicos en el área de estudio, unadiversidad de morfotiposposiblemente relacionada con cantidad de recursos y losdistintos microhábitats antropogénicos disponibles.
Palabras clave: Estimador poblacional Petersen, Cutín de Quito, patrones morfológicos, recursos, microhábitats.
Abstract: Green areas in large cities can host a great biodiversity, providing shelter to different native taxa whose adaptive dynamics with respect to demographic changes are interesting to explore. An important group in urban green areas are amphibians, indicators of the current state of an ecosystem. We focus on the Striped Robber Frog Pristimantis unistrigatus to know its ecology within a green area of the city. We use a capture-recapture method by photo identification, in November 2015 and January 2016, on the campus of the Universidad Central del Ecuador. Using the Petersen population estimator, we estimated a population of 1749 individuals and a population density of 40 individuals per hectare. Most individuals were females and were found in the herbaceous stratum. Pristimantis unistrigatus showed eight morphological patterns in the studied area, a diversity of morphotypes probably related with the amount of available resources and different anthropogenic microhabitats.
Keywords: Petersen population estimator, Striped Robber Frog, morphological patterns, resources, microhabitats.
INTRODUCCIÓN
La ciudad de Quito se ha expandido en grandes proporciones en los últimos años [1,2], a pesar de ello, se conoce que grandes metrópolis pueden albergar una variada diversidad de especies de flora y fauna en sus áreas verdes. Estas áreas son de vital importancia como refugio de la biodiversidad local y pueden mostrar datos importantes sobre su comportamiento y adecuación hacia ambientes alterados [3]. El Campus de la Universidad Central del Ecuador cuenta con aproximadamente 44 hectáreas, de las cuales el 40% son áreas verdes [4] y, como varios de los espacios urbanos en Quito, posee distintos tipos de vegetación que brinda servicios ambientales a la ciudadanía junto con refugios para la biodiversidad [5].
Dentro de la riqueza de especies que podemos encontrar en las áreas verdes de la ciudad se encuentra la rana Cutín de Quito (Pristimantis unistrigatus), de la familia Strabomantidae. Esta especie se distribuye en valles interandinos desde el sur de Colombia hasta el Ecuador central, siendo localmente abundante y habitando en pastizales o áreas cultivadas entre los 2200 a 3400 m sobre el nivel del mar, y es común escucharla cantando en los jardines de Quito [6]. Se presume que el éxito de este tipo de anuros que se asientan en zonas urbanas o fragmentadas se da debido a su desarrollo directo (no presentan etapa larval), lo que incrementa las probabilidades de sobrevivencia y adaptación al reproducirse con éxito independientemente de la presencia de cuerpos de agua [7].
Debido a que el crecimiento urbano en el Neotrópico se está incrementando de una manera incontrolada, se hace cada vez más importante realizar estudios de ecología urbana para tomar acciones de conservación [8]. En Ecuador, pocos son los trabajos que se han realizado para analizar la situación de la fauna urbana, aun así, se han elaborado programas de educación ambiental como alternativas que puedan luchar contra la desaparición de especies [9]. Es necesario estudiar más a fondo las dinámicas de los anfibios en zonas urbanas ya que, su población presenta declives muy notorios, por estar sometidos a barreras antrópicas extremas que impiden su desplazamiento a otros ecosistemas menos alterados [10, 11].
El urbanismo implica ciertos cambios ambientales que juegan un papel importante en la reproducción y desarrollo de los anfibios [12]. Aunque las perturbaciones en el ambiente sean fuertes, existen especies adaptadas que han desarrollado una gran flexibilidad para utilizar una amplia gama de hábitats, lo cual involucra plasticidad conductual o incluso morfológica como respuesta hacia los cambios del ambiente, variando según lasnecesidades individuales determinadas por el estadio de desarrollo o sexo [13,14]. Entrelas adaptaciones al medio están las variaciones de coloración, las cuales suelen tenerfunciones de termorregulación, comunicación y evasión de predadores [15]. En el caso delos anuros existe evidencia que la coloración suele estar relacionada con el entorno y eltipo de microhábitat en donde habitan los individuos [16].
Los anuros tienen un ciclo de vida complejo, con varios puntos de transición y de cambios morfológicos, fisiológicos, ecológicos y de comportamiento, y aun cuando algunos no presenten etapas larvales, se considera que durante dichos cambios existen diferencias en el aprovechamiento del entorno, lo que se denomina plasticidad fenotípica. De esta manera, algunos anfibios se adaptan a situaciones de perturbación, depredación y eventos ambientales que de otro modo los exterminaría [17].
Un campus universitario puede actuar como un mosaico geográfico ya que las áreas verdes están conectadas de manera intermitente, lo que puede generar cambios entre las subpoblaciones que se puedan formar, lo cual podría verse evidenciado en los patrones de coloración [18]. el presente trabajo buscó estimar el tamaño poblacional y uso de hábitat de P. unistrigatus en el campus universitario de la Universidad Central del Ecuador, y evaluar si existen diferencias entre el estadio, tamaño o sexo y la preferencia de estrato de percha, para así contribuir con información que permita comprender el estado de dicha especie en ambientes urbanos.
MATERIALES Y MÉTODOS
El presente estudio fue realizado en el campus de la Universidad Central del Ecuador, ciudad de Quito (Fig. 1), con una extensión de 44 ha, de las cuales el 40% son áreas verdes [4]. Este campus no tiene conexión con otras áreas verdes de la ciudad ni con la parte occidental en las faldas del volcán Pichincha y se encuentra a una altura de 2830 m sobre el nivel del mar (Fig. 2). La temperatura y humedad durante el trabajo de campo en noviembre 2015 (captura) fueron en promedio 12,8 ± 1,3 °C y 83,8 ± 3,3% respectivamente, mientras que, en enero 2016 (recaptura) la temperatura promedio fue 12,0 ± 1,1 °C y la humedad promedio 86,4 ± 1,0%.
Ubicación del campus de la Universidad Central del Ecuador (UCE) dentro de la ciudad de Quito, Pichincha, Ecuador.
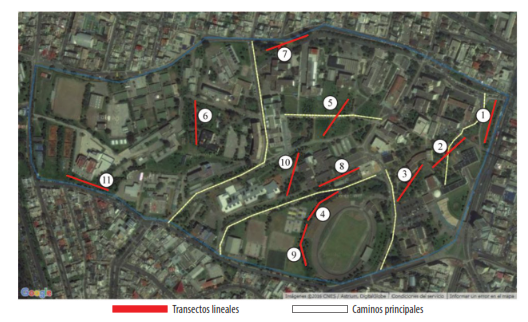
Distribución de los once transectos lineales en las áreas verdes estudiadas del campus de la Universidad Central del Ecuador (UCE), Quito, Pichincha. Fuente: Google Maps, 2016
Siguiendo la propuesta realizada por Lips y Reaser [19], se establecieron once transectosde 100 × 3 m a lo largo de las áreas verdes del campus universitario que forman islas separadas por las estructuras de concreto entre ellas, como edificios, aulas, talleres, graderíos, calles y caminos. La mayoría de estas áreas verdes son pastizales de cesped, similares en composición de especies y estructura a otros que se pueden encontrar en las áreas verdes de toda la ciudad. En estos pastizales, además del césped, se pueden encontrar arbustos y árboles de especies introducidas como Eucalyptus globulus, Populus sp., Callistemon viminalis, C. citrinus y especies nativas como Tecoma stans, Delostoma integrifolium, entre otros [4]. Los transectos TH01, 02 y 05 se caracterizaron por ser zonas abiertas en su mayoría, cubiertas por pastizal y la presencia de vegetación arbustiva y arbórea muy distanciada entre sí, se ubicaron junto a calles y caminos principales. Por otro lado, los transectos TH03 y 07 fueron zonas muy abiertas con espacio reducido, los transectos apenas cubrían su extensión y estaba caracterizada casi solo por pastizal junto a calles principales. Los transectos TH04, 08, 09, 10 y 11 estuvieron en áreas con la presencia de vegetación nativa, fueron zonas poco transitadas por la comunidad universitaria, además presentaron pequeñas zonas con escombros y materiales desechables como barras de hierro, tubos entre otros. El transecto TH06 se caracterizó principalmente por tener un humedal artificial junto con vegetación asociada a un cuerpo de agua, con zonas cubiertas de arbustos y árboles. Los muestreos se realizaron entre las 20h30 y las 01h30, debido a la actividad universitaria en la zona de estudio no se inició el trabajo más temprano.
El estudio en campo se realizó mediante los métodos estandarizados de monitoreo para anfibios descritos por Crump y Scott [20] y Angulo et al. [21]. Los individuos fueron capturados manualmente y depositados en una funda plástica de 30 × 45 cm, designándoles un código y registrando características ambientales como estratos, hora de colecta y tipo de percha. En cada transecto se puso una cinta de marcaje por punto de colecta para luego liberarlos en el punto de extracción. En este estudio no se colectó ningún individuo.
Para la identificación de P. unistrigatus se utilizó la descripción propuesta por Lynch [22] y respaldada por Ron et al., [6] y Hoyos et al., [23], además de tipificar juveniles, hembras y machos. Los machos adultos fueron identificados por la presencia de un saco vocal dilatado y menor tamaño en la longitud rostro-cloacal (LRC), en comparación con las hembras de mayor tamaño en LRC, que fueron diferenciadas además por carecer de saco vocal [24]. En las hembras grávidas era posible observar la existencia de huevos a través de la piel ventral. Se tomaron medidas morfométricas de los individuos capturados con un calibrador digital (marca Vernier, precisión = 0,01 mm). Para los análisis morfológicos se excluyó a los individuos juveniles ya que no mostraban los caracteres bien desarrollados para la identificación a nivel de especie [25]. Los individuos fueron pesados con una balanza mecánica mono plato con pesas corredizas en unidad de gramos, y a cada individuo se le tomó fotografías de la parte dorsal, considerando los patrones morfológicos de manchas negras como “marcajes” para reconocimiento de los individuos capturados, método probado en dendrobátidos [26], en hílidos [27], en hemifráctidos [28] y en bufónidos [10]. Para evaluar los patrones de variación morfológica de los individuos de P. unistrigatus se tomó en cuenta los registros digitales tomados para el marcaje. Estos patrones permitieron clasificar un patrón básico en machos y hembras junto con las variaciones a partir de ellos. Esto se pudo establecer tras la ejecución de un muestreo prospecto aleatorio en el cual se observó diferencias físicas entre individuos capturados tanto para machos y hembras, siendo los patrones dorsales los más definitivos para distinguirlos entre sí al momento de realizar una selección aleatoria de los anfibios capturados y previamente registrados fotográficamente, con el fin de disminuir los errores de identificación entre individuos [29]. La presición de identificación manual entre individuos ya ha sido demostrada anteriormente en distintos trabajos como menciona Alzate-Lozano et al. [30] (Fig.3)

Variación base de los patrones dorsales en P. unistrigatus dentro del campus universitario de la Universidad Central del Ecuador . Hembras: A= Manchas negras pronunciadas con unos círculos dorsales inferiores; B=Línea central rostro cloacal junto con manchas negras entre cortadas paralelas a la central; C=Pigmentos negros muy marcados en todo el dorso junto con pequeños pigmentos blancos; D= Manchas negras menos pronunciadas con unos círculos dorsales inferiores y con puntos blancos. Machos: E= Manchas negras no tan pronunciadas con unos círculos dorsales inferiores; F= Línea central rostro cloacal negra junto con manchas negras paralelas continuas a la central; G=Base de la piel color naranja con pequeñas manchas negras en el dorso; H=Base de la piel totalmente negra con pequeños o ausentes pigmentos café.
Se utilizó estadística descriptiva para determinar la estructura de la población de acuerdo con los datos obtenidos en el campo mediante el programa Microsoft Excel 2010, usando un intervalo de confianza del 95%. Para la estimación de la población se usó la fórmula de Petersen considerando los datos de la captura obtenidos tras la fotoidentificación de los individuos por su patrón dorsal, realizando luego de un mes una segunda ronda de muestreo para identificar las posibles recapturas dentro de esta población considerada cerrada [31]. Además, se calculó la densidad poblacional tomando en cuenta los datos generados por el estimador de Petersen dividido para el número de hectáreas que corresponden al área de estudio.
Para caracterizar la preferencia de percha nocturna en P. unistrigatus, se definió el tipo de percha en cinco categorías: 1: Herbáceo, 2: Arbustivo, 3: Arbóreo, 4: Hojarasca, 5: Otros. Dentro de la categoría 5 se consideran los estratos antrópicos (asentamientos urbanísticos como concreto, desechos orgánicos e inorgánicos, mallas de alambre, etc.) y demáselementos como troncos, rocas o raíces. Se realizó el análisis de varianza Kruskall-Wallispara muestras independientes, considerando datos no paramétricos con el fin de observarsi existe diferencia entre el tipo de percha nocturna y el tamaño de los individuos de P. unistrigatus, por otro lado, para establecer si existen diferencias entre la preferencia de lapercha según el sexo (macho y hembra), se aplicó U de Mann–Whitney [32].
RESULTADOS Y DISCUSIÓN
Se capturó un total de 299 individuos de P. unistrigatus, distribuidos dentro de los once transectos ya mencionados (Fig. 2), siendo las hembras las más numerosas dentro de la zona de estudio. El estimador de Petersen mostró un valor de 1749 individuos, en términos de densidad representa 40 ind/ha, considerando que solo el 4,7% (n=14) fueron recapturados (Tabla 1). El número de individuos en el primer muestreo fue mayor que en el segundo, siendo las hembras las más numerosas en ambos casos. Esta baja tasa de recaptura podría estar influida por las condiciones climáticas entre las dos sesiones de muestreo, pues la temperatura promedio varió 0,79 ºC, y la humedad media al menos 2,53%.
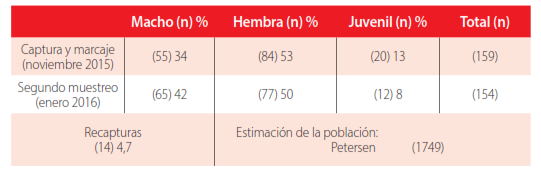
Estadio, número y porcentaje de individuos junto con la estimación de la población de Pristimantis unistrigatus durante la captura – recaptura en el campus universitario UCE
Dos de los 11 transectos, denominados TH03 y 07 no presentaron registros en ninguno de los dos muestreos, tres transectos presentaron menos del 1% de los registros totales (TH01, 02 y 05), Dentro de las áreas con más abundancia de P. unistrigatus está el transecto TH06 (27,79%) donde se pudo observar un parche de vegetación y un pequeño humedal artificial. Los transectos TH04, 08, 09, 10 y 11 presentaron más del 10% de los registros, teniendo en común parches de vegetación nativa y espacios poco transitados ya sea por su pendiente o la ubicación retirada de las principales áreas de interés para la comunidad universitaria (aulas, oficinas, laboratorios, entre otros).
El tipo de percha más usado por P. unistrigatus fue el herbáceo con más de la mitad de los individuos registrados en este estrato, mientras que el menos común fue el sustrato denominado "Otros", que incluyó registros en concreto, barras de hierro (oxidadas), tubos de metal y mallas de alambre (Fig. 4). No existieron diferencias estadísticamente significativas entre el tamaño tanto de las hembras (H= 2,44; .= 0,65) como de los machos (H=1,20; p= 0,87) y el tipo de estrato elegido para la percha nocturna. Seencontraron diferencias significativas entre la preferencia de percha y el sexo (Z= 2,93, p= 0,001) lo cual se puede apreciar en la Fig. 5. Los juveniles están presentes en losestratos más cercanos del suelo.
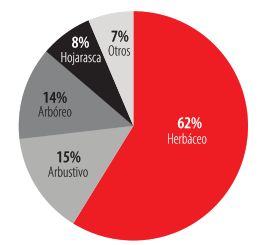
Relación entre el tipo de percha nocturna y el porcentaje total del número de individuos de P. unistrigatus colectados en la captura-recaptura (n=299).
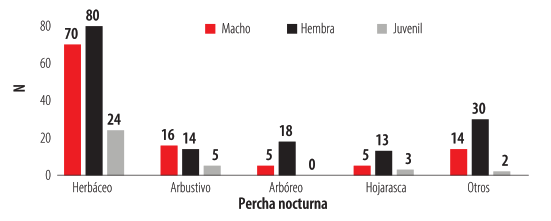
Preferencia del tipo de percha nocturna elegida y el sexo (macho y hembra) de los individuos identificados durante la captura-recaptura.
El análisis de las fotografías de los patrones dorsales de los individuos de P. unistrigatus registrados dio como resultado cuatro morfos para hembras y cuatro para machos. En el caso de hembras (Fig. 3) predomina una pigmentación negra en una base café clara, los patrones negros se extienden desde la línea dorso cloacal hacia los flancos, en algunos casos con pigmentos blancos. Los machos (Fig. 3) presentan más variación , con patrones dorsales desde pigmentos negros similares a la hembra, con la base desde rojiza hasta anaranjada oscura y negra, y los pigmentos negros pueden estar en forma de líneas siguiendo la LRC, poco presentes hasta casi todo el dorso cubierto de este color. El patrón (D) en hembras posee características similares al patrón (E) de los machos, solo que con lapigmentación dorsal de fondo más oscuro y pequeños puntos blancos conspicuos (Fig. 3).
Existen pocos estudios que evalúan poblaciones de anfibios, específicamente en el género Pristimantis, pese a ser uno de los grupos altamente diversos en el Neotrópico. Es por esta razón que este estudio es un punto de partida para aclarar la relación del estado poblacional de una especie de Pristimantis que habita distintos ambientes (urbanos y rurales), Funk et al. [33 ] presentó un estudio que analizó poblaciones de espe- cies del género Pristimantis en Yanayacu, provincia de Napo, Ecuador, reportando densidades para P. simonbolivari (564 ind/ha), P. eriphus (154 ind/ha), P. lanthanites (129 ind/ha) y P. martiae (99 ind/ha), con altos valores de densidad poblacional con respecto a nuestro trabajo. El estudio de Velásquez-Trujillo et al. [34], realizado en Colombia con P. calcaratus, obtuvo 91 ind/ha. La menor densidad registrada en el presente estudio podría deber a que los estudios antes citados se realizaron en zonas de mayor superficie, cubiertas por vegetación nativa, y lejos de zonas urbanas.
Es importante continuar estudiando las poblaciones urbanas de anfibios para conocer de mejor manera si estas podrían sufrir futuros declives poblacionales por distintas causas como aislamiento urbano [35] o enfermedades o malformaciones, como las reportadas por Yánez-Muñoz et al. [26] y Ramírez y Rodríguez [28].La población de P. unistrigatus podría aumentar si se incrementan las áreas verdes dentro del campus universitario, principalmente usando vegetación nativa y restringiendo el paso de los usuarios en áreas estratégicas para permitir un remanente para los anfibios. También se puede implementar conexiones que puedan ser utilizadas por los anfibios, principalmente entre los transectos TH04, 06, 08, 09, 10 y 11. Se pueden tener en cuenta áreas verdes fuera del campus como el bosque nativo de la zona de Armero que se encuentra junto a la avenida Mariscal Sucre, cerca del campus universitario y que representa un área mayor que puede contener poblaciones más establecidas del Cutín de Quito. Conseguir establecer conexiones entre estos parches de vegetación a pesar de las barreras humanas podría favorecer enormemente el desarrollo futuro de estas poblaciones de anfibios [10,26].
Los resultados de este estudio sugieren que no existe segregación en el uso de perchas según el tamaño del individuo, pero si por su sexo. En la relación entre el tipo de percha nocturna entre machos hembras y juveniles se mostró que en su mayoría los individuos prefieren las plantas herbáceas, las hembras adultas fueron más abundantes en el estrato arbóreo. Este patrón coincide con el estudio de García y colaboradores en el 2008 con Pristimantis jubatus, donde los individuos adultos ocuparon estratos más altos que los juveniles [36]. Pristimantis unistrigatus utilizó con mayor frecuencia las hierbas seguidas por arbustos, concordando con el estudio de Molina-Zuluaga y Gutiérrez-Cárdenas [37]. Esta preferencia se podría deber a la importancia de la estructura física de la percha para evitar la exposición frente a depredadores más que la preferencia del tipo de especie vegetal [38]. Por otro lado, las ranas de hábitos arbóreos o las que prefieren estar más lejos del suelo tienen un sistema de forrajeo pasivo que les permite capturar presas móviles mientras perchan [39,40]; de forma que se reduzca el peligro de depredación [41]. Para explicar la preferencia de los juveniles podrían deberse a que los anuros pueden cambiar su dieta a medida que crecen, siendo los artrópodos más pequeños disponibles los que se encuentran en estratos más cercanos del suelo [42].
Los registros de diferentes morfos para P. unistrigatus fueron de gran ayuda para la identificación en la recaptura mediante foto identificación, semejante a los métodos usados por Yánez-Muñoz et al. [10], Ramírez y Rodríguez [28], Alzate-Lozano et al., [30].
Lynch [22] describe que la coloración del dorso contiene cuatro patrones morfológicos, mientras que Ron et al. [6] describen cinco patrones morfológicos del dorso. Sin embargo, para este estudio se describen ocho patrones morfológicos del dorso considerando los dos sexos. Estos cambios en los patrones morfológicos de coloración son evidentes y a menudo se encuentra ligados a su base genética [43]. Los patrones encontrados en este estudio podrían estar relacionados con la disponibilidad de recursos existentes y la diversidad de microhábitats que permiten a la especie suplir sus necesidades fisiológicas [30], algo que sugiere también Ortega-Andrade et al. [27] en su estudio poblacional de Agalychnis spurrelli.
A pesar de que Pristimantis unistrigatus se encuentra bajo la categoría de Preocupación Menor (LC) en la lista roja de anfibios del Ecuador [44] podría en un futuro evidenciar su desaparición en áreas urbanas muy aisladas e intervenidas, lo que representaría además una pérdida de la identidad cultural con la naturaleza, teniendo en cuenta que esta es una especie emblemática de la ciudad de Quito.
AGRADECIMIENTOS
A las Biólogas Silvana Gallegos, Paulina Guarderas y Cecilia Tobar, por sus sugerencias de ecología de poblaciones para el presente trabajo. A Erick Acosta, Dulce Jordán, Patricio Mora, Iván De la Cruz por su colaboración en la fase de campo. A los biólogos Juan Francisco Rivadeneira por la representación en la carrera de Ciencias Biológicas y Ambientales de la UCE, Gonzalo Soto por la logística durante el estudio en el campus universitario junto con el Centro de Biología. A Malki Bustos, por la prestación de una cámara fotográfica para el registro digital. A la Doctora Jessica Guarderas, por su guía en los análisis estadísticos. A la Universidad Central del Ecuador por los permisos necesarios para la ejecución del proyecto dentro del campus. A los dos revisiores anónimos y al editor que contribuyeron en gran proporción al mejoramiento del manuscrito con sus valiosos comentarios.
CONTRIBUCIONES DE LOS AUTORES
Hernán Orellana-Vásquez concibió la investigación, realizó la fase de campo junto a Alex Achig-Vega, Katherine Nicolalde y Mariana Duque, Luna Barragán-Tabares realizó los análisis e interpretación de los datos y contribuyó en la redacción del manuscrito.
CONFLICTO DE INTERESES
Los autores declaran no tener conflicto de intereses en relación a la publicación de este artículo.
REFERENCIAS
[1] Scovazzi, E. (2018). Centros históricos y cultura urbana en América Latina. Ciudades, (3), 135-154. doi: https://doi.org/10.24197/ciudades.03.1996.135-154
[2] Rodríguez, C. P. (2018). Rehabilitación urbana y pobreza oculta, La Mariscal, Quito. Bitácora Urbano Territorial, 28(2), 17-24. doi: https://doi.org/10.15446/bitacora.v28n2.70065
[3] Amador-Oyola, L. (2015). Fauna urbana de Guayaquil: el caso de los anfibios y reptiles, nuestros vecinos menospreciados. Yachana Revista Científica, 4 (Edición Especial noviembre de 2015), 181-188. doi: https://doi.org/10.1234/ych.v0i0.150
[4] Salvador, J. D. (2013). Análisis comparativo de los métodos de cálculo del tiempo de concentración en la red de Alcantarillado del Campus Universitario. Tesis de titulación. Carrera de Ingeniería Civil. Quito: UCE. p. 253. http://www.dspace.uce.edu.ec/handle/25000/1709
[5] Murray, S. (1998). El Ecosistema Forestal Urbano En Quito. En Silvicultura Urbana y Periurbana en Quito, Ecuador: Estudio de Caso. https://www.fao.org/3/W7445S/w7445s04.htm#3.%20el%20ecosistema%20forestal%20urbano%20en%20quit
[6] Ron, S. R., Frenkel, C., Varela-Jaramillo, A. y Guayasamín, J. M. (2018). Pristimantis unistrigatus. En Ron, S. R., Merino- Viteri, A. Ortiz, D. A. (Eds). Anfibios del Ecuador. Version 2021.0. Museo de Zoología, Pontificia Universidad Católica del Ecuador. https://bioweb.bio/faunaweb/amphibiaweb/FichaEspecie/Pristimantis%20unistrigatus, acceso, junio 2018.
[7] Becker, C. G., Fonseca, C. R., Haddad, C. F. B., Batista, R. F. y Prado, P. I. (2007). Habitat split and the global decline of amphibians. Science, 318, 1775–1777. doi: http://doi.org/10.1126/science.1149374
[8] Barragán-Vásquez M., Zenteno Ruíz C., Solis Surita C., López Luna M., Hernández Estañol E., Martínez Zetina M., Ríos Rodas L., Hernández Velásquez J., Rodríguez Sánchez Y., Peregrino Reyes D., Rodríguez Azcuaga G. y González Ramón M. (2010). Herpetofauna Asociada a Ambientes Urbanos y Sub urbanos de Villahermosa, Tabasco, México. Kuxulkab,Revista de divulgación, 16(30), 19-26. https://www.researchgate.net/publication/345974426_Herpetofauna_asociada_a_ambientes_urbanos_y_suburbanos_de_Villahermosa_Tabasco_Mexico
[9] Jácome Mejía, A. E. (2017). Diseño de un programa de interpretación y educación ambiental en el parque Guápulo, Quito, Ecuador. Tesis de titulación. Carrera de Turismo Ecológico. Quito: UCE. p. 128. http://www.dspace.uce.edu.ec/handle/25000/9662
[10] MECN. (2009). Guía de Campo de los Pequeños Vertebrados del Distrito Metropolitano de Quito (DMQ), Publicación Miscelánea N° 5. Serie de Publicaciones del Museo Ecuatoriano de Ciencias Naturales (MECN) – Fondo Ambiental del MDMQ. 1-89 pp. Imprenta Nuevo Arte. Quito-Ecuador.
[11] Ron S. R., Merino, A. (2000). “Declinación de anfibios del Ecuador: información general y primer reporte de Chytrodiomicosis para Sudamérica”, pp. 2-3. https://multimedia20stg.blob.core.windows.net/publicaciones/Ron_&_Merino_2000.pdf
[12] Babini, M. S., Salas, D. E., Bionda, C. L. y Martino, A. L. (2015). Implicaciones de la urbanización en la presencia, distribución y ecología reproductiva de la fauna de anuros de una ciudad del área central de Argentina. Revista mexicana de biodiversidad, 86(1), 188-195. doi: https://doi.org/10.7550/rmb.43684
[13] Rubbo, M. J. y Kiesecker, J. M. (2005). Amphibian breeding distribution in an urbanized landscape. Conservation Biology, 19(2), 504–511. https://www.jstor.org/stable/3591262
[14] Sih, A., Ferrari, M. C. O. y Harris, D. J. (2011). Evolution and behavioural responses to human‐induced rapid environmental change. Evolutionary applications, 4(2), 367–387. doi: https://doi.org/10.1111/j.1752-4571.2010.00166.x
[15] Endler, J. A., Wescott, D. A., Madden, J. R. y Tobson, T. (2005). Animal visual systems and the evolution of colour patterns: sensory processing illuminates signal evolution. Evolution, 59(8), 1795–1818. doi: http://doi.org/10.1111/j.0014-3820.2005.tb01827.x
[16] Toledo, L. y Haddad, C. (2009). Colors and some morphological traits as defensive mechanisms in anurans. International Journal of Zoology, 2009, 910892. doi: https://doi.org/10.1155/2009/910892
[17] María, D., Vera, F. y Vaira, C. M. (2019). Plasticidad fenotípica en diferentes etapas del ciclo de vida de Phyllomedusa boliviana y Phyllomedusa sauvagii (Anura: Phylllomedusidae): respuesta ante factores bióticos y abióticos. Tesis doctoral. Facultad de Ciencias Naturales e Instituto Miguel Lillo. http://hdl.handle.net/11336/97933
[18] Carranza Almansa J. (2003). La evolución del sexo. En M. Soler (Ed.) Evolución. La base de la biología. Proyecto sur de ediciones.
[19] Lips K. y Reaser, J. (1999). “El monitoreo de Anfibios en América Latina”, The Nature Conservancy. https://amphibiaweb.org/resources/Anfibios.pdf
[20] Crump, M. L. y Scott, N. J. (1994). Visual Encounter Survey. En W. R. Heyer, M. A. Donnelly, R. W. McDiarmid, L. C. Hayek y M. S. Foster (Eds.), Measuring and Monitoring biological diversity. Standard methods for Amphibians (pp. 84- 92). Smithsonian Institution Press.
[21] Angulo, A., Rueda-Almonacid, J. V., Rodríguez-Mahecha, J. V. y La Marca, E. (2006). Técnicas de inventario y monitoreo para los anfibios de la región tropical andina, Conservación Internacional. Serie Manuales de Campo N.º 2. Panamericana Formas e Impresos S.A.
[22] Lynch, J. D. 1981. Leptodactylid frogs of the genus Eleutherodactylus in the Andes of Northern Ecuador and adjacent Colombia. The University of Kansas, Museum of Natural History Miscellaneous Publications, 72, 1-46.
[23] Hoyos, J., Mantilla, C., Galindo, D. y Salgar, L. (2014). Phylogenetic analysis whithin the Pristimantis unistrigatus (Anura, Craugastoridae) group based on morphological characters. Caldasia, 36(1), 107-124. doi: https://doi. org/10.15446/caldasia.v36n1.43894
[24] Lynch, J. D. y Duellman, W. E. (1980). The Eleutherodactylus of the Amazonian slopes of the Ecuadorian Andes (Anura: Leptodactylidae). The University of Kansas, Museum of Natural History, Miscellaneous Publications, 69, 1-86.
[25] Duellman, W.E. y Lehr, E. (2009). Terrestrial-Breeding frogs (Strabomantidae) in Perú. Natur und Tier-Verlag.
[26] Yánez-Muñoz, M., Mesa-Ramos, P., Altamirano, M. B. y Castro, C. M. (2010). Estado poblacional de una rana nodriza (Anura: Dendrobatidae: Hyloxalus delatorreae), críticamente amenazada, en los Andes Norte de Ecuador. Boletín Técnico, Serie Zoológica 6, 38-64. https://journal.espe.edu.ec/ojs/index.php/revista-serie-zoologica/article/ view/1428
[27] Ortega-Andrade, H. M., Tobar-Suárez, C. y Arellano, M. M. (2011). Tamaño poblacional, uso del hábitat y relaciones interespecíficas de Agalychnis spurrelli (Anura: Hylidae) en un bosque húmedo Tropical remanente del noroccidente de Ecuador. Papeís Avulsos de Zoología, 51(1), 1-19. doi: https://doi.org/10.1590/S0031-10492011000100001
[28] Ramírez, S. M. y Rodríguez, M. L. (2019). Estado poblacional y relaciones ecológicas de Gastrotheca riobambae (Anura: Hemiphractidae) en dos localidades del Volcán Pasochoa, Pichincha – Ecuador. Boletín técnico, Serie Zoológica, 10(7), 69-97. doi: https://journal.espe.edu.ec/ojs/index.php/revista-serie-zoologica/article/view/1449
[29] Arnason, A. N. y Mills, K. H. (1981). Bias and loss of precision due to tag loss in Jolly-Seber estimates for mark- recapture experiments. Canadian Journal of Fisheries and Aquatic Science, 38(9), 1077-1095. doi: http://doi. org/10.1139/f81-148
[30] Alzate-Lozano, S., Lozano-Osorio, R. y Galvis, C. (2018). Parámetros poblacionales de la rana dorada, Phyllobates terribilis (Myers et al., 1978) (Dendrobatidae), en una localidad de Buenaventura, Valle del Cauca, Colombia. Biota colombiana, 19(1), 133-146. doi: https://doi.org/10.21068/c2018.v19n01a09
[31] Donnelly, M. A. y Guyer, C. (1994). Estimating population size. En W. R. Heyer, M.A. Donnelly, R. W. McDiarmid, L C. Hayek y M. S. Foster (Eds). Measuring and monitoring biological diversity. Standard methods for Amphibians. Smithsonian Institution Press.
[32] Zar, J. H. (1998). Biostatistical analysis (4th edition). Prentice Hall.
[33] Funk, W. K., Almeida-Reinoso, D., Nogales-Sornosa, F. y Bustamante, M. R. (2003). Monitoring Population Trends of Eleutherodactylus Frogs. Journal of Herpetology, 37(2), 245-256. doi: https://doi.org/10.1670/0022-1511(2003)037[0245:MPTOEF]2.0.CO;2
[34] Velásquez-Trujillo, D. A., García, W. B. y López, A. G. (2014). Ensamblaje de anuros y estado poblacional de Pristimantis calcaratus (Anura: Craugastoridae), Bitaco, la Cumbre-Colombia, Universidad del Valle. Facultad de Ciencias Naturales y Exactas. Departamento de Biología, pp. 1-9. doi: http://doi.org/10.13140/RG.2.2.21159.14247
[35] Saunders, D. A., Hobbs, R. J. y Margules, C. R. (1991). Biological consequences of ecosystem fragmentation: a review. Conservation Biology, 5(1), 18-32. doi: http://doi.org/10.1111/j.1523-1739.1991.tb00384.x
[36] García, R. J. C., Lucas-Velásquez, L., Cárdenas, H. H. y Posso, G. C. E. (2012). Ecología alimentaria de la rana de lluvia endémica Pristimantis jubatus (Craugastoridae) en el Parque Nacional Natural Munchique, Colombia. Acta Biológica Colombiana, 17(2), 411-420. http://www.scielo.org.co/scielo.php?pid=S0120-548X2012000200014&script=sci_ abstract&tlng=es
[37] Molina-Zuluaga, C. y Gutiérrez-Cárdenas, P. G. A. (2007). Uso nocturno de perchas en dos especies de Anolis (Squamata: Polychrotidae) en un bosque Andino de Colombia. Papeís Avulsos de Zoología, 47(22), 273-281. doi: https://doi.org/10.1590/S0031-10492007002200001
[38] Rubbo, M. J. y Kiesecker, J. M. (2005). Amphibian breeding distribution in an urbanized landscape. Conservation Biology, 19, 504–511. doi: https://doi.org/10.1111/j.1523-1739.2005.000101.x
[39] Guayasamin J. M., Bonaccorso E., Menéndez P. A. y Bustamante M. R. (2004). Morphological variation, diet, and vocalization of Eleutherodactylus eugeniae (Anura: Leptodactylidae) with notes on its reproduction and ecology. Herpetological Review, 35(1), 17-23. https://www.academia.edu/33236673/Morphological_variation_diet_and_vocalization_of_Eleutherodactylus_eugeniae_Anura_Leptodactylidae_with_notes_on_its_reproduction_and_ecology
[40] Santos E. M., Almeida A. V. y Vasconcelos S. D. (2004). Feeding habits of six anuran (Amphibia: Anura) species in a rainforest fragment in Northeastern Brazil. Iheringia. Série Zoologia, 94(4), 433-438. doi: https://doi.org/10.1590/S0073-47212004000400014
[41] Toft, C. A. (1985). Resource partitioning in amphibians and reptiles. Copeia, 1985(1), 1-21. doi: https://doi. org/10.2307/1444785
[42] Leyte-Manrique, A., González-García, R. L. E., Quintero-Díaz, G. E., Alejo-Iturvide, F., & Berriozabal-Islas, C. (2018). Aspectos ecológicos de una comunidad de anuros en un ambiente tropical estacional en Guanajuato, México. Acta zoológica mexicana, 34. doi: https://doi.org/10.21829/azm.2018.3412138
[43] O’Neill, E. M. y Beard, K. H. (2010). Genetic basis of a color pattern polymorphism in the coqui frog Eleutherodactylus coqui. Journal of Heredity, 101(6), 703-709. doi: https://doi.org/10.1093/jhered/esq082
[44] Ortega-Andrade HM, Rodes Blanco M, Cisneros-Heredia DF, Guerra Arévalo N, López de Vargas-Machuca KG, et al. (2021) Red List assessment of amphibian species of Ecuador: A multidimensional approach for their conservation. PLOS ONE 16(5): e0251027. https://doi.org/10.1371/journal.pone.0251027