



Artículos
REGENERACIÓN DE PLANTAS DE TOMATE DE ÁRBOL (Solanum betaceum) A PARTIR DE PROTOPLASTOS.
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
ISSN: 1390-5384
ISSN-e: 2528-7788
Periodicidad: Bianual
vol. 1, núm. 1, 2008
Publicación: 01 Abril 2009

Resumen: El tomate de árbol (Solanum betaceum) es un frutal de origen andino que posee el potencial necesario para convertirse en un producto de importancia económica dentro de los mercados internacionales de exportación. El objetivo principal de esta investigación fue estandarizar un protocolo para el aislamiento de protoplastos a partir de hojas, y la obtención de plantas viables de tomate de árbol. Las modificaciones incorporadas al protocolo original permitieron obtener división de los protoplastos en todos los ensayos. Con la metodología utilizada, se obtuvo un promedio de eficacia de extracción y aislamiento de protoplastos de 4,21 x 105 protoplastos por ml. La eficiencia de formación de callos a partir de los protoplastos aislados fue baja con valores en promedio de 0,11%. Sin embargo, la regeneración de retoños a partir de los callos obtenida fue exitosa y se lograron valores de hasta el 68%. Los resultados de esta investigación demuestran que la regeneración de retoños a partir protoplastos en tomate de árbol es eficaz. En esta investigación se obtuvo plantas viables de tomate de árbol regeneradas a partir de protoplastos, lo que constituye un paso primordial para estudios posteriores, como hibridación somática, transformación genética o inducción de variación somaclonal. Técnicas que pueden contribuir al establecimiento de programas de fitomejoramiento que ayuden a incrementar los niveles de producción de esta planta.
Palabras clave: Protoplastos, Tomate de árbol, Cultivo in-vitro.
Introducción
El tomate de árbol (Solanum betaceum) es un arbusto semileñoso que alcanza una altura de 2 a 3 metros y que pertenece a la familia Solanaceae. Es una especie originaria de los Andes, y crece en climas templados y fríos. El fruto es de forma ovoide o elipsoide puntiagudo, de piel lisa con mucílago de color morado, rojo, amarillo o anaranjado. En el Ecuador, el área de cultivo de tomate de árbol es de aproximadamente 5900 hectáreas, ubicadas principalmente en la Sierra [1].
En la gastronomía ecuatoriana, esta fruta tiene varios usos. Puede ser consumido directamente, o puede ser utilizado para la preparación de jugos, dulces, mermeladas, salsas y ensaladas [2]. Posee un alto valor nutricional. 100g de fruta aportan: proteínas (2g), calcio (9mg), fósforo (41mg), y ácido ascórbico (29mg), además es rico en niacina (1.07mg) y hierro (0.90 mg) [3].
La susceptibilidad del tomate de árbol a enfermedades ha causado una disminución en el cultivo de esta fruta en el Ecuador a partir del 2005 [4]. Las principales enfermedades que afectan a este cultivo son: antracnosis, oidium y nemátodos. Los nemátodos son los que causan la mayor reducción en la producción de tomate de árbol, ya que atacan a las raíces, restringiendo la absorción de nutrientes, lo que provoca un limitado desarrollo de la planta [1].
Estudios de variabilidad genética realizados en cultivares ecuatorianos de este frutal, han revelado la existencia de una reducida diversidad genética [5]. Este hallazgo plantea una limitación para programas de mejoramiento tradicional, mediante cruzas entre las diferentes variedades, lo cual sugiere la necesidad de buscar fuentes alternativas de diversidad. En este sentido, el cultivo in vitro de protoplastos puede ser una alternativa ya que es el punto de partida para la realización de hibridizaciones interespecíficas, intragenéricas o para la transformación genética [6-8].
Los protoplastos son células vegetales a las que se les ha removido la pared celular. Klercker en 1892 fue el primero en aislar protoplastos mediante disrupción mecánica de la pared celular. Sin embrago no fue hasta 1960 que Cocking obtuvo altas densidades de protoplastos utilizando el método enzimático [7,8]. A partir de entonces se ha obtenido plantas regeneradas a partir de protoplastos en un sinnúmero de especies vegetales. Las condiciones de aislamiento de estas células varían entre las diferentes especies, de acuerdo al tipo de tejido utilizado, concentración de enzimas, pH de la solución enzimática (pectinasas y celulasas), y condiciones osmóticas de las soluciones utilizadas. Los medios de cultivo necesarios para la posterior regeneración de retoños a partir de los protoplastos aislados también se adaptan a los requerimientos específicos de cada especie [7-10].
El objetivo principal de esta investigación fue estandarizar un protocolo para el aislamiento de protoplastos a partir de hojas y cotiledones, y la obtención de plantas viables de tomate de árbol.
Materiales y métodos
Material Vegetal
Para el aislamiento de protoplastos se utilizó hojas de plántulas de tomate de árbol de 1 mes de edad, cultivadas in-vitro, de la variedad comercial amarillo puntón, las cuales fueron mantenidas en oscuridad por 3 días, antes de empezar el tratamiento enzimático.
Aislamiento de protoplastos
Se utilizó el protocolo de aislamiento y cultivo de protoplastos a partir de hojas de tabaco [11] con las siguientes modificaciones; se remplazó la solución CPW con manitol al 13% por una solución CPW con manitol al 10%. El pH de la solución CPW con enzimas fue reducido a 5,6.
Cultivo de protoplastos
Los protoplastos aislados fueron sembrados en densidades que variaron entre 2,76 x 105 y 9,86 x 105 embebidos en gotas de Mprot suplementado con sucrosa al 10% más agarosa. Las gotas tenían un diámetro de aproximadamente 1 cm y fueron colocadas en una caja petri a la que se agregó Mprot líquido con sucrosa al 10%[11].
Resultados y discusión
Edad del tejido inicial
Los cotiledones y las hojas de plántulas germinadas in- vitro, de 1 mes de edad, fueron el mejor material inicial para el aislamiento de protoplastos. Con estos tejidos se obtuvieron protoplastos de mejor aspecto al microscopio (mayor número de protoplastos intactos). Los tejidos de mayor edad, provenientes de subcultivos sucesivos in vitro, dieron como resultado un número alto de protoplastos destruidos. Adicionalmente las hojas de más de 1 mes de edad no produjeron la densidad de protoplastos necesaria para la siembra de los mismos.
Observaciones similares se han obtenido en otros estudios donde en especies como el espárrago, se comprobó que la edad del tejido inicial fue crítica para el éxito del proceso de aislamiento de protoplastos [10,].
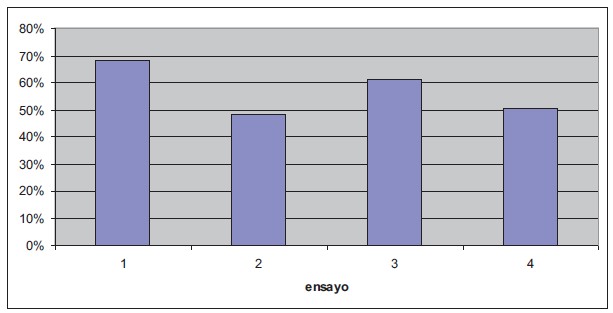
| Ensayo | 1 | 2 | 3 | 4 |
| Volumen de protoplastos obtenidos | 1,5 ml | 1,2 ml | 1 ml | 1 ml |
| Densidad de protoplastos por ml | 6,12 x 105 | 2,8 x 105 | 2,82 x 105 | 2,76 x 105 |
| Total protoplastos obtenidos (volumen x densidad) | 9,18 x 105 | 3,36 x 105 | 2,82 x 105 | 2,76 x 105 |
Tabla 1 Densidades de protoplastos obtenidos en los 4 ensayos realizados.
Los protoplastos sembrados se incubaron en la oscuridad por 4 días a 28o C. Posteriormente, se cultivaron en un fotoperiodo de 16 horas luz y 8 horas oscurdidad. Al cabo de una semana, el Mprot líquido con sucrosa al 10%, fue remplazado por una solución de Mprot líquido con sucrosa al 3%, donde permanecieron entre 2 - 3 semanas. Al cabo de este tiempo, cada gota se dividió en 4 secciones, las cuales pasaron a una caja Petri con medio MS sólido [12] suplementado con benzilaminopurina (BAP) 4 ppm y ácido naftalénacético (NAA) 0.05 ppm.
Aproximadamente a las 4 - 5 semanas del cultivo de los protoplastos, se aislaron microcallos que fueron colocados en una nueva caja Petri con medio MS + BAP
4 ppm y NAA 0,05 ppm. Se prosiguió con los subcultivos de los callos cada 21 días. Los retoños regenerados a partir de los callos se colocaron en frascos de vidrio con medio MS, donde permanecieron hasta que desarrollaron raíces.
Las plántulas con raíces se pasaron a tierra estéril en recipientes de barro dentro de un frasco de vidrio donde fueron aclimatadas paulatinamente a la humedad ambiental durante 2 semanas. Una vez aclimatadas las plantas fueron transferidas a bolsas plásticas de siembra con tierra.
Pre-tratamiento del material inicial
El tratamiento de las plántulas in vitro en oscuridad por 3 días, previos a la extracción de protoplastos, tuvo un efecto positivo, ya que se obtuvo una densidad mayor en la fase de separación de los protoplastos en la solución de sucrosa al 20%. En otros estudios se ha demostrado también que, en algunas especies con altos contenidos de almidones en sus células, los valores de protoplastos obtenidos aumentaron al someter las plantas a la oscuridad por 3 días. Esto puede deberse principalmente a que los protoplastos aislados de hojas que han crecido en la luz acumulan gran cantidad de gránulos de almidón en el citoplasma, lo cual impide que los protoplastos sean aislados por flotación y hace difícil el ajuste osmótico de las soluciones de aislamiento [13].
Otro factor que influyó en la eficiencia de aislamiento de protoplastos, fue la reducción del pH de la solución enzimática. En observaciones al microscopio se pudo ver que a un pH 5,6 hubo una mayor degradación de las paredes celulares y se obtuvo una solución de protoplastos de color verde oscuro, indicando mayor densidad de células, que con un pH de 5,8. Aparentemente, un pH 5.6 es óptimo para las enzimas degradativas usadas. Estas observaciones se asociaron también con mejores rendimientos en la formación de paredes celulares y una alta tasa de división celular.
Estos hallazgos son comparables con estudios realizados para aislar protoplastos en varias especies vegetales e incluso algunos hongos en donde los pH más altos, dieron menores rendimientos en la densidad de protoplastos obtenida [14].
Densidades de protoplastos efectivas para la siembra Las densidades de protoplastos obtenidas en esta investigación variaron entre 2,76 x 105 - 9,86 x 105 protoplastos por ml como se puede observar en la Tabla
Los protoplastos incubados a 28º C iniciaron su división celular al tercer día después del aislamiento. En la Figura 1 se pueden observar las diferentes etapas de división de protoplastos. En Liriodendron tulipifera de la familia de las magnolias y en Ceratonia siliqua (algarrobo), también se observó que la división celular de protoplastos empieza en este mismo periodo [9,13].
1. A estas densidades fue posible establecer el cultivo de estas células. Estos datos concuerdan con las densidades (5x 102 a 1 x 106 protoplastos por ml) utilizadas para el cultivo de protoplastos en medio sólido en otras especies [6].
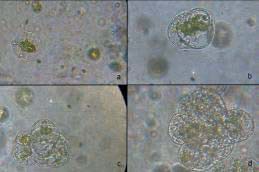
Figura 1. Primeras divisiones de los protoplastos en medio de cultivo Mprot.(a) Protoplastos a los 4 días de cultivo, se observa la primera división. (b) Protoplastos a los 7 días de cultivo, se observan colonias de 4 células. (c) Protoplastos a los 9 días de
En el caso de la densidad más alta, 9,86 x 105 protoplastos por ml, la división celular y la formación de microcallos iniciaron antes que en densidades bajas de protoplastos Sin embargo, los microcallos resultantes de esta densidad empezaron a necrosarse y murieron a las 2 semanas de iniciado el cultivo. Este fenómeno puede deberse al agotamiento de nutrientes por la competencia generada por la alta tasa de división celular o por la acumulación de sustancias tóxicas como fenoles que pueden impedir el desarrollo normal de los callos [6].
Comparando los resultados de los diferentes experimentos realizados, se pudo determinar que la mayor eficiencia en formación de callos se obtuvo en los experimento 3 y 4 (0.26% y 0.145%) cuando se utilizaron densidades entre de 1,41 x 105y 2,76 x 105 protoplastos por ml, respectivamente, como se puede observar en la Tabla 2. Este resultado concuerda con un estudio realizado en Liriodendron tulipifera, una planta leñosa, en donde se observó una elevada división celular en protoplastos sembrados en una densidad de 2-4 x 105 protoplastos por ml [12]
Sin embargo, el mayor porcentaje de formación de retoños se obtuvo en el experimento 1 (68%) en donde la densidad de protoplastos obtenidos fue 6,125 x 105 (Figura 2). Esta diferencia entre eficacia de formación de callo y porcentaje de formación de retoños puede deberse principalmente a que al producirse un menor número de microcallos se puede optimizar las formación de retoños debido a una menor competencia entre los agregados celulares por los nutrientes disponibles en el medio y el efecto hormonal. El porcentaje promedio de formación de retoños fue del 57%. Los retoños obtenidos presentaron morfología normal y en dos semanas se obtuvieron plántulas enraizadas que pudieron ser aclimatadas y transferidas a tierra con un porcentaje de supervivencia del 85% (Figura 3).
Este estudio reporta un protocolo eficiente de aislamiento y purificación de protoplastos en tomate de árbol a partir de hojas y cotiledones cultivados in vitro. La metodología descrita en esta investigación permitirá la realización de estudios posteriores que contribuyan al fitomejoramiento de esta interesante planta andina de potencial económico para el Ecuador.

Agradecimientos
Esta investigación fue financiada por el convenio USFQ-CONESUP dentro del marco del proyecto: “Estrategias biotecnológicas para la determinación de la variabilidad genética y la búsqueda de resistencia al nemátodo agallador en tomate de árbol”
Adicionalmente agradecemos a los integrantes del Laboratorio de Biotecnología Vegetal de la Universidad San Francisco de Quito por su apoyo y contribuciones al desarrollo de este proyecto.
Referencias bibliográficas
1. Servicio de Información y Censo Agropecuario. Ministerio de Agricultura, Ganadería, acuacultura y Pesca del Ecuador. Censo del tomate de árbol. 2005
2. Federación Nacional de cafeteros de Colombia. El cultivo del tomate de arbol
3. Orihuela M. 1997 Tomate andino, manual práctico para su cultivo y uso Centro “Bartolomé de Las Casas.
4. BCE. Banco Central del Ecuador. 2005. Estadísticas andina-pais. Partida 0819030000.
5. Peñafiel N. et all 2007. Evaluación de la variabilidad genética del tomate de árbol (Solanum betaceum Cav.) en los cultivos de tres provincias del Ecuador por medio de marcadores microsatélites. Universidad San Francisco de Quito. Quito Ecuador
6. Dixon R. A. and Gonzales R. A. 1994 Plant Cell Culture A practical Approach. Oxford University Press. .
7. George J. Wagner; Henry C. Butcher IV; Harold W. Siegelman 1978 The Plant Protoplast: A Useful Tool for Plant Research and Student Instruc.tion. BioScience, 28: pp. 95-101
8. Navratilova B. Protoplast 2004 cultures and protoplast fusion focused on Brassicaceae.Horticulture science (Prague) 4: pp. 140-157
9. Merkle S. A.; Sommer H. E. 1987 Regeneration of liriodendron tulipifera (family magnoliaceae) from protoplast culture.American Journal of Botany, 76: pp 1317-1321
10. Chen Guangyu A. J. Conner; M. C. Christey; A. G. Fautrier; R. J. Field. 1997 Protoplast Isolation from Shoots of Asparagus Cultures. International Journal of Plant Science, 158: pp. 537-542.
11. Reinert M; Yeoman M. 1982. Plant Cell and Tissue Culture
12. Murashige, T y F. Skoog. “.A revised medium for rapid growth and bioassays with tobacco tissue cultures”. Physiol. Plant 15 (1962): 473-497.
13. Simens J. and Sacristán M. D. 1994 Plant regeneration from mesophyl protoplasts of matthiola incana. Plant cell reports pp. 446-449
14. Gary B. Dunphy; Richard A. Nolan. Effects of Physical Factors on Protoplasts of Entomophthora egressa Mycologia, Vol. 71, No. 3. (May - Jun., 1979), pp. 589-602.
Penelope Sotirioua,, Stephen C. Fryb and Caroline G. Spyropoulos. 2007 Protoplast isolation and culture fromcarob (Ceratonia siliqua) hypocotyls: ability of regenerated protoplasts to produce mannose-containing polysaccharides. Physiologia Plantarum 130: pp. 11-22

