



Construcción y operación de una cámara anaeróbica de bajo costo para la siembra y el cultivo de bacterias sulfato reductoras
Construction and operation of a low-cost anaerobic chamber for culturing of sulfate reducing bacteria
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
Recepción: 14 Noviembre 2018
Aprobación: 09 Enero 2019
Resumen: El objetivo del presente estudio fue construir y operar una cámara anaeróbica no costosa para el cultivo de bacterias sulfato reductoras (BSRs) en muestras ambientales de lodos. Una vez construida la cámara, las condiciones anaeróbicas al interior de la cámara fueron evaluadas a través del monitoreo de la concentración de oxígeno y la temperatura. En la cámara anaeróbica se alcanzaron las condiciones de anaerobiosis (< 0,1% O2) y la temperatura requerida (30°C) para el cultivo de las BSRs. A continuación, se cultivó en placa (en un medio selectivo) cuatro muestras diferentes de lodo que fueron incubadas, contadas y microscópicamente observadas. Los resultados por cultivo en placa fueron comparados con los de contaje directo en cámara de Neubauer. Habiéndose demostrado que las condiciones ambientales en la cámara son las adecuadas para el cultivo de microorganismos anaeróbicos estrictos, las BSRs también fueron observadas mediante microscopía. En base a los resultados obtenidos por cultivo en placa y por recuento en cámara de Neubauer se determinó que no hubo diferencias significativas en la muestra de suspensión bacteriana, a diferencia de las muestras de lodos. Si bien es cierto que el cultivo de microorganismos demanda tiempo, esta técnica sigue siendo útil y confiable para el conteo microbiano. Finalmente, la cámara anaeróbica construida permite el cultivo de microorganismos anaeróbicos estrictos como las BSRs, responsables de la bioprecipitación de metales.
Palabras clave: cámara anaeróbica, cultivo, bacterias sulfato reductoras, recuento.
Abstract: This study aimed to construct and operate a low-cost anaerobic chamber for culturing of sulfate-reducing bacteria (SRBs) in environmental sludge samples. We constructed the chamber and tested anaerobic conditions through monitoring of oxygen concentration and temperature. In the anaerobic chamber, anaerobiosis (< 0,1% O2) and the required temperature (30 °C) were reached to cultivate SRBs. Then, four different sludge samples were plate cultured (in a selective medium), incubated, counted and observed by microscopy. Enumeration results obtained using culture plating were compared with those obtained by Neubauer chamber counting. Once we demonstrated that environmental conditions in our chamber are suitable for culturing of strict anaerobic microorganisms, microscopically, we observe development of colonies and cells of SRBs. A comparison ofthe results obtained by plate culturing with those obtained by counting in Neubauer chamber showed that there were not significant differences in sample of bacterial suspensions, unlike sludge samples. Although, culture of microorganisms is time consuming, this technique is useful and reliable. Finally, our in-house chamber allows the growing of anaerobic microorganisms such as SRB which are responsible for the bioprecipitation of metals.
Keywords: anaerobic chamber, culture, sulfate reducing bacteria, counting.
INTRODUCCIÓN
En la actualidad muchos microorganismos son cultivados a escala industrial debido a su versatilidad y variedad de aplicaciones. Por ejemplo, los microorganismos están siendo utilizados para producir moléculas bioactivas y biomateriales, los microorganismos también están siendo modificados genéticamente y se los cultiva para estandarizar cepas, o por sus aplicaciones en procesos de biorremediación y de biología sintética [1]. Además, con frecuencia es necesario cultivar microorganismos para enumerar la cantidad de microorganismos viables y establecer tasas de crecimiento y muerte celular [2-3].
Debido al inmenso número de especies microbianas existentes, de las cuales sólo una pequeña fracción es cultivable bajo condiciones de laboratorio; se han desarrollado modernas técnicas moleculares tales como los análisis metagenómicos combinados con secuenciación masiva, para el estudio de las comunidades microbianas ambientales o patógenas, y para entender su diversidad, filogenia y ecología [2, 4-5]. Aun así, el cultivo de microorganismos continúa siendo fundamental para la identificación, aislamiento y recuento de células viables o para establecer su uso potencial en aplicaciones biotecnológicas subsecuentes [1-2, 4]. Por tal motivo, es un desafío desarrollar y optimizar técnicas convencionales de cultivo, sobre todo en la bioprospección de microorganismos presentes en muestras ambientales de matrices complejas [2, 3, 6-7].
Entre los microorganismos de interés, las bacterias sulfato reductoras (BSRs) conforman un grupo diverso y ubicuo de procariotas anaeróbicos estrictos, que son parte fundamental de los ciclos globales del azufre y del carbono [8-10]. Las BSRs se caracterizan por ser las responsables de reducir sulfato a sulfuro como parte de su metabolismo y el sulfuro biogénico cataliza la bioprecipitación de metales durante la biorremediación de efluentes de la industria minera [11-12]. Las BSRs están presentes en variedad de hábitats anaeróbicos: sedimentos marinos, pantanos, microbiota intestinal, sistemas de tratamiento de aguas residuales industriales o instalaciones de extracción de gas y petróleo [9-10]. Microscópicamente, las BSRs son de color negro o pardo y tienen diversas formas como cilindros, derechos o curvos, ovoides, cocos, entre otros [6].
El cultivo de microorganismos incluye la recolección de muestras, la preparación de diluciones, la siembra en medios selectivos de cultivo, y la incubación bajo condiciones controladas y reproducibles [2]. En medios sólidos de cultivo, el crecimiento microbiano se evidencia en el desarrollo de agrupaciones de muchas bacterias, formadas a partir de una o varias células viables (unidades formadoras de colonias, UFC), denominadas colonias [13-17]. Al tratarse de microorganismos anaeróbicos, las BSRs tienen períodos de incubación de hasta 30 días, dependiendo de la tasa de crecimiento de cada cepa [13]. Las condiciones adecuadas de incubación para el cultivo de BSRs se dan en una atmósfera inerte, con una proporción variable de dióxido de carbono para el crecimiento de ciertas especies y como máximo 0.1% de oxígeno; esto, en un rango óptimo de temperatura entre 25 y 40oC, aunque algunas termófilas pueden desarrollarse por sobre los 70oC [6-7]. Adicionalmente, los medios de cultivo selectivos para las BSRs son aquellos cuya relación de fuente de carbono expresada como demanda química de oxígeno (DQO), respecto a la concentración sulfato está en el rango de 0,8 a 1,7 [15].
Debido a que el oxígeno tiene efecto bactericida y/o bacteriostático sobre los microorganismos anaeróbicos estrictos, debe obtenerse una atmósfera libre de este gas para alcanzar el óptimo crecimiento celular; igualmente son importantes la temperatura de crecimiento y la composición adecuada del medio de cultivo [18-19]. Los sistemas anaeróbicos para siembra y/o cultivo incluyen botellas para bioensayos en matriz líquida, requieren jarras de incubación tipo GasPak y cámaras flexibles o rígidas provistas de guantes aislantes. Las cámaras rígidas con guantes son las más apropiadas y versátiles; aunque su costo inicial es alto y, en ocasiones, la imposibilidad de establecer condiciones de cultivo para microorganismos específicos suela ser una desventaja [19].
En este contexto, el objetivo del presente estudio fue construir una cámara anaeróbica rígida del tipo caja con guantes de bajo costo; y, probar su funcionamiento en la siembra, cultivo y recuento de las BSRs por la técnica de vertido en placa. Las muestras ambientales analizadas corresponden a lodos de sedimentos de una laguna artificial, lodos anaeróbicos enriquecidos, lodos provenientes de un biorreactor sulfato reductor y una suspensión bacteriana. Las condiciones de anaerobiosis fueron monitoreadas al interior de la cámara, siendo medidas la temperatura y la concentración de oxígeno durante la operación del sistema. La viabilidad cualitativa de los microorganismos anaeróbicos fue evaluada a través de la observación microscópica de las células y las colonias. Además, los resultados obtenidos por recuento en placa fueron comparados con los de conteo celular directo mediante cámara de Neubauer.
El presente trabajo es innovador por la potencial aplicación de esta cámara en un amplio rango de experimentos microbiológicos en que se requieran condiciones anaeróbicas de siembra y cultivo [19].
MATERIALES Y MÉTODOS
Requerimientos estructurales
Un sistema de ambiente anaeróbico debe ser eficiente y capaz de alcanzar productividad óptima en un espacio compacto. Por tal motivo, el volumen interno de la cámara anaeróbica es idealmente de entre 0,1 y 0,3 m3, con capacidad de hasta 200 placas por lote de incubación y que permita el trabajo y movilidad, controlando todos los procedimientos de siembra [19-20]. Los materiales de construcción de la cámara deben ser resistentes y facilitar la limpieza adecuada del ambiente de trabajo [21]. Los costos del proceso de construcción y puesta en marcha fueron registrados en el periodo comprendido desde octubre de 2016 hasta enero de 2017, y el costo total fue actualizado a valor presente (año 2018).
Requerimientos operativos
Las condiciones operativas óptimas para el crecimiento de las BSRs mesófilas son rangos de temperatura de 28-32°C y atmósfera anaeróbica a presión normal de 1 atm, constituida por una mezcla gaseosa formada mayormente (80%) por un gas inerte como el nitrógeno (N2) y, 20% de dióxido de carbono (CO2) ya que es requerido para el adecuado metabolismo de algunas especies [9]. Para monitorear las condiciones de anaerobiosis, la concentración de oxígeno (O2) fue medida en el tiempo, utilizando un medidor OPTIMA 7 BIOGAS (Humble, TX, USA) del proyecto IDEMA del Departamento de Ingeniería Química de la USFQ. Y, la temperatura fue monitoreada utilizando un termómetro digital 4126 Control Company (Webster, TX, USA) del Laboratorio de Ingeniería Ambiental de la USFQ (LIA-USFQ). Las medidas ergonómicas de trabajo fueron consideradas de tal manera que prevengan desórdenes músculo-esqueléticos de los operadores [22].
Medio de cultivo
El medio basal mineral (MBM) estuvo compuesto por: 280 mg L-1 NH4Cl; 195 mg L-1 KH2PO4 ; 49 mg L-1 MgSO4 ; 10 mg L-1 CaCl2 ; 3.000 mg L-1 NaHCO3 ; 10 mg L-1 extracto de levadura; 2.900 mg L-1, Na2SO4 ; 5.300 mg L-1 CH3 COONa y 1 mL L-1 de una solución de elementos traza. La solución de elementos traza estuvo constituida por: 50 mg L-1 H3BO3 ; 2.000 mg L-1 FeCl2 ∙4H2O; 50 mg L-1 ZnCl2 ; 32 mg L-1 MnCl2; 50 mg L-1 (NH4)6 Mo7O24 ∙4H2O; 50 mg L-1 AlCl3 ; 2.000 mg L-1 CoCl2∙6H2O; 50 mg L-1 NiCl2∙6H2O; 44 mg L-1 CuSO4. 5H2O; 100 mg L-1 NaSeO3∙5H2O; 1.000 mg L-1 EDTA; 200 mg L-1 resarzurina y 1 mL L-1 de ácido 32 clorhídrico al 36% [23]. La resarzurina contenida en la solución de elementos traza funciona como indicador para observar la posible pérdida de anaerobiosis [19].
El medio de cultivo fue preparado con MBM suplementado con acetato de sodio (JT Baker Chemical Company. Phillipsburg, NJ, USA) como fuente de carbono, en una concentración equivalente a 2,5 g DQO L−1 y 2,0 g SO42− L−1 a partir de sulfato de sodio 4 (JT Baker Chemical Company. Phillipsburg, NJ, USA), en una proporción acetato/sulfato de 1,25:1. El pH del medio de cultivo fue ajustado con ácido clorhídrico o hidróxido de sodio, según fuera el caso, hasta alcanzar valores de entre 7,8 y 8,2 [6-7].
Obtención y preparación de las muestras
Lodos de una laguna artificial: Una muestra de lodos anaeróbicos fue recolectada de los sedimentos tomados a una profundidad aproximada de 1,2 m, en una laguna artificial en el campus Cumbayá de la Universidad San Francisco de Quito (USFQ), Ecuador. Los lodos fueron almacenados a 4oC hasta su uso. El contenido de los sólidos suspendidos totales (SST ) y de los sólidos suspendidos volátiles (SSV) en el lodo fueron 51,7 y 5,9%, respectivamente. La actividad sulfidogénica máxima específica fue 4.337 mg S2- kg-1 SSV d-1.
Lodos anaeróbicos enriquecidos: Esta muestra fue obtenida a partir de lodos anaeróbicos, los mismos descritos en la sección previa que fueron enriquecidos en medio de cultivo líquido. El enriquecimiento fue llevado a cabo bajo condiciones anaeróbicas y por triplicado, utilizando medio líquido de cultivo estéril y añadiendo 10% p/v de lodo anaeróbico. El medio de cultivo no fue reemplazado durante todo el tiempo de incubación. Utilizamos botellas de vidrio estériles de 160-mL de capacidad, que fueron herméticamente selladas con tapas de caucho y aluminio. El aire contenido en el espacio de cabeza o headspace fue desplazado con N2 y las botellas fueron incubadas durante 45 días bajo oscuridad en una incubadora a 30±2°C. Una vez concluido el periodo de incubación, la muestra fue analizada por los dos métodos de enumeración propuestos.
Lodos de un biorreactor sulfato reductor: Una muestra de lodo fue obtenida de un biorreactor sulfato reductor a escala laboratorio, provisto de una pre-columna de piedra caliza, durante la remoción de cobre (II); en dicho reactor había sido monitoreada su actividad sulfato reductora durante dos años [24]. La muestra fue colectada en un recipiente estéril de plástico y almacenada a 4oC hasta su enumeración.
Suspensión bacteriana: Diluciones de lodo sulfato redactor enriquecido fueron sembradas en un medio de cultivo sólido, al que se le añadió 1,5% p/p de agar (BactoTM Agar, Difco Laboratories, Bordeaux, France). Después de un período de incubación de entre 28 y 30 días a 30oC bajo condiciones anaeróbicas [14], las colonias aisladas fueron re-suspendidas en botellas estériles conteniendo medio líquido de cultivo. Después de someter el cultivo a las mismas condiciones de incubación que las de las muestras de lodo enriquecido, la suspensión bacteriana fue inmediatamente sometida a conteo en cámara de Neubauer y recuento en placa.
Microscopía
Las células bacterianas de colonias y en las suspensiones fueron observadas por microscopía de luz (microscopio Leica AME. Werzlar, Germany). No se utilizó ninguna coloración. Para el objetivo 100 X se usó aceite de inmersión y no se utilizó ninguna coloración.
Enumeración celular mediante cámara de Neubauer
Al mismo tiempo de la siembra en placa, el número total de BSRs presentes en las muestras fue analizado mediante una cámara de Neubauer 0,1 mm depth (BOECO, Hamburg, Germany); y, durante la etapa exponencial de crecimiento [25-26]. En cada caso, la muestra fue diluida en solución salina estéril (0,9% NaCl, p/v). Debido al color negro característico de las BSRs, no se requirió tinción alguna [27]. El número total de BSRs por mL fue calculado siguiendo las instrucciones proporcionadas por el fabricante. El recuento total de BSRs incluye tanto las células viables como las no viables. Todas las muestras fueron analizadas por triplicado.
Recuento bacteriano en placa
Para cuantificar las BSRs viables, una alícuota de 1 mL de cada muestra fue serialmente diluida en 9 mL de medio de cultivo líquido estéril. Dentro de la cámara anaeróbica, una alícuota de 100 μL de muestra no diluida (100) y de cada dilución (10-1 to 10-9) fueron sembradas por triplicado por vertido en placa [14]. El medio de cultivo suplementado con 1,5% agar fue previamente esterilizado y enfriado a 45oC, para luego dispensar un volumen de entre 20 y 25 mL por placa o caja Petri. Se incluyeron controles negativos que consistieron en medio de cultivo sin muestra. A continuación, también al interior de la cámara anaeróbica, las placas de agar fueron incubadas en una atmósfera N2/CO2 (N2 AP grado 4,8 y CO2 AP grado 2,8. Linde, Quito, Ecuador), en proporción 80:20, a 30±0.5°C durante 28-30 días. Finalmente, las colonias fueron contadas. El número de BSRs viables, expresado como unidades formadoras de colonias (UFC) por mL, fue calculado dividiendo el número de colonias para el volumen de muestra y multiplicando ese valor por el factor de dilución. Cada muestra fue analizada por triplicado.
Análisis estadístico
Los resultados fueron comparados mediante análisis de varianza (ANOVA), con 95% de intervalo de confianza, utilizando el software SPSS Statistics (IBM Corp., Nueva York, USA).
RESULTADOS
Descripción de la cámara anaeróbica
Las especificaciones y ficha técnica de la cámara anaeróbica construida constan en la Fig. 1. El equipo tiene un solo compartimento hermético cuyas dimensiones son 100 cm de largo, 50 cm de ancho y 60 cm de altura; con un volumen útil de trabajo de 0,2 m3. La cámara fue construida en acero al carbono ASTM 380, luego se le imprimó una capa de antioxidante para dar la terminación superficial con una pintura termoconvertible de base epóxica. Tiene una escotilla oblicua de apertura frontal y bisagras con mecanismo de retardo, así como cerradura. Cuenta, además, con una ventana de vidrio templado de 80 cm por 25 cm y 5 mm de espesor; y, un sello de caucho en todo el perímetro, que garantiza la hermeticidad del sistema.
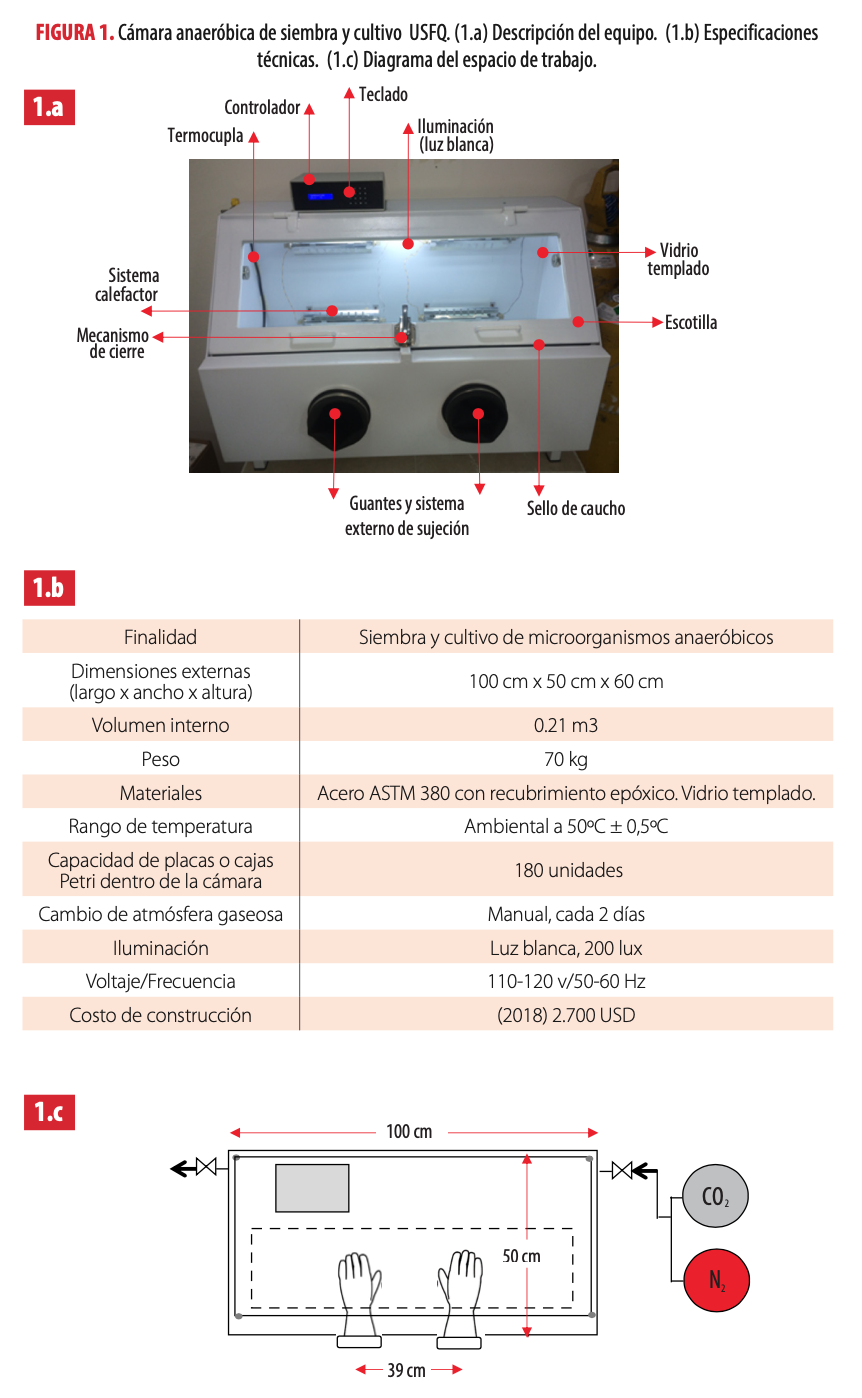
Cámara anaeróbica de siembra y cultivo USFQ. (1.a) Descripción del equipo. (1.b) Especificaciones técnicas. (1.c) Diagrama del espacio de trabajo.
Para procesar y sembrar las muestras, la cámara está equipada en su panel frontal con mangas de guantes de látex de 60 cm de largo, resistentes al ataque químico, que pueden ser regularmente reemplazados, y cuyo cuadro de paso es 39 cm. En la pared posterior interna, cuatro resistencias simples del defrost de un refrigerador constituyen el sistema calefactor que permite alcanzar en el interior de la cámara una temperatura máxima de 50 ̊C, un rango adecuado para el cultivo de BSRs y otros microorganismos anaeróbicos de interés.
El costo actual (2018) de construcción de la cámara, que incluye materiales, mano de obra, instalación eléctrica, acoples, montaje, control automático y puesta en marcha, es en total de 2.700 USD.
Operación de la cámara anaeróbica
La cámara anaeróbica opera con suministro eléctrico de 110 voltios y cuenta con un interruptor en la parte externa superior izquierda que permite encender el equipo. La cámara aneróbica posee un módulo que activa la iluminación al interior de la cámara; mientras que dos puertos han quedado libres para controlar el generador de ozono y la lámpara luz ultravioleta, que serán posteriormente instalados como mecanismos de desinfección del área de trabajo.
La temperatura al interior de la cámara anaeróbica es manejada mediante un controlador PID para temperatura, cuyos parámetros del controlador PID, proporcional “P”, integral “I” y diferencial “D”, fueron obtenidos con el criterio de sintonía de Ziegler-Nichols [28]. Estas variables operativas de control de temperatura son ingresadas al controlador PID mediante un teclado ubicado en la parte superior izquierda de la cámara anaeróbica, que está provisto de una pantalla que también permite visualizar la temperatura interna durante toda la operación.
Por otra parte, la atmósfera anaeróbica es conseguida por procedimiento manual, mediante el desplazamiento del aire a través de una mezcla gaseosa de 80% de N2 y 20% de CO2. Para ello, la cámara cuenta con dos válvulas y terminales de manguera, una en la parte inferior derecha para el ingreso de la mezcla gaseosa y otra en la parte superior izquierda para la salida. El tiempo de purga o flushing, abriendo ambas válvulas, al inicio de la siembra y cultivo es de 15 minutos y cada 48 horas, durante el periodo de incubación, se hace una purga preventiva o de mantenimiento de cinco minutos de duración, equivalente a cinco veces el cambio del volumen interno de la cámara anaeróbica.
En la Fig. 2 se presenta la concentración de oxígeno y la temperatura al interior de la cámara anaeróbica. En la Fig. 2.a se puede observar que se alcanzaron las condiciones anaeróbicas ya que la concentración de oxígeno disminuyó de 21% a 0,1% durante los 10 primeros minutos y se mantuvo en este rango [7]. Cabe indicar que, durante la ejecución de los experimentos, las condiciones anaeróbicas se mantuvieron dentro de la cámara ya que la concentración de oxígeno no superó el 0,1%; de igual manera, la temperatura requerida fue estable y, por ende, el mecanismo de control instalado funcionó eficientemente (Fig. 2.b). A partir de los 10 minutos, se obtienen condiciones anóxicas y desde los 12 minutos, aproximadamente, se llega a la temperatura de control establecida, correspondiente a 30oC.
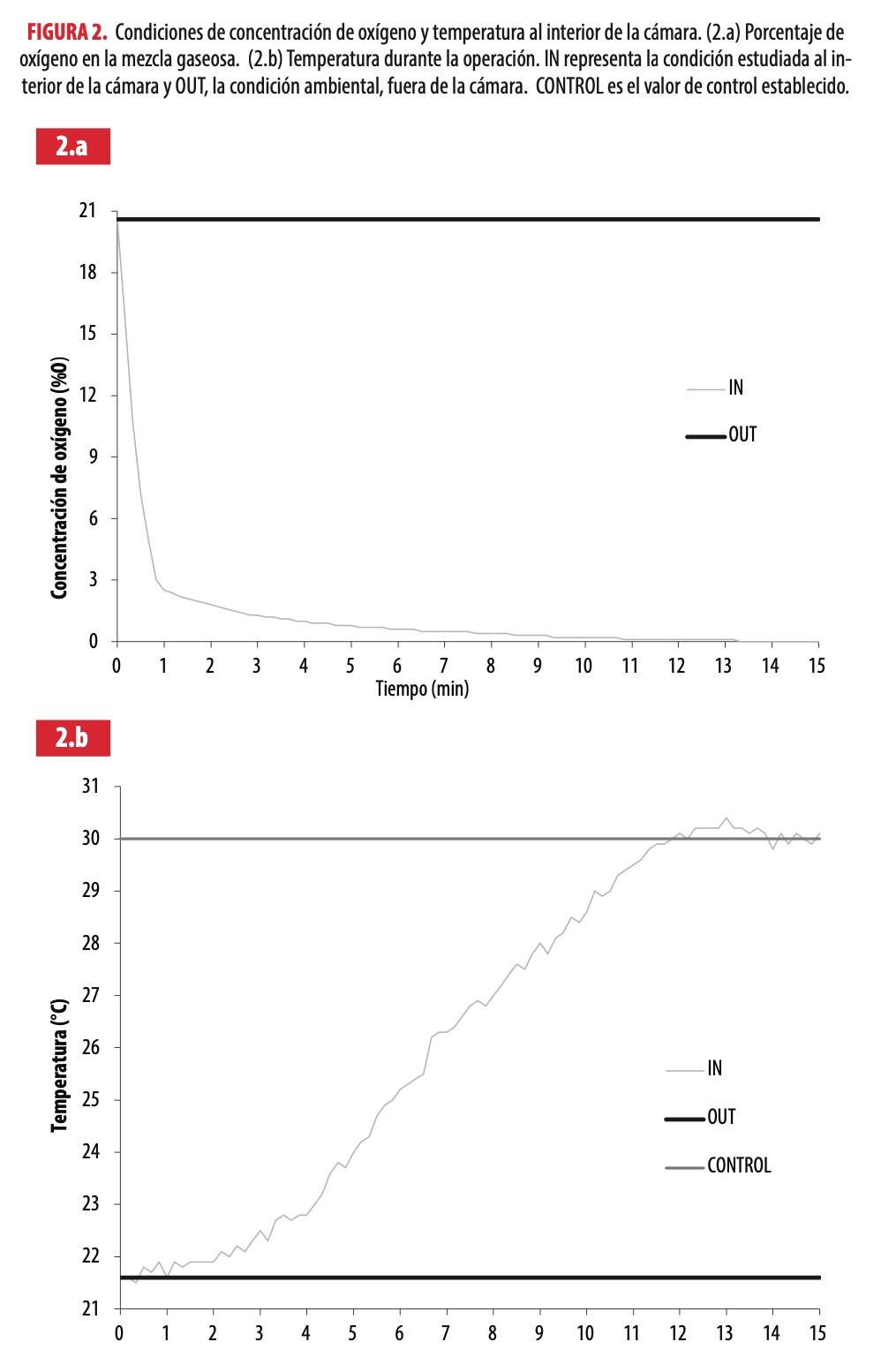
Condiciones de concentración de oxígeno y temperatura al interior de la cámara. (2.a) Porcentaje de oxígeno en la mezcla gaseosa. (2.b) Temperatura durante la operación. IN representa la condición estudiada al interior de la cámara y OUT, la condición ambiental, fuera de la cámara. CONTROL es el valor de control establecido.
En la actualidad, la cámara se encuentra funcionando con normalidad en uno de los laboratorios de Ingeniería Ambiental de la USFQ (LIA-USFQ).
Cultivo de BSRs
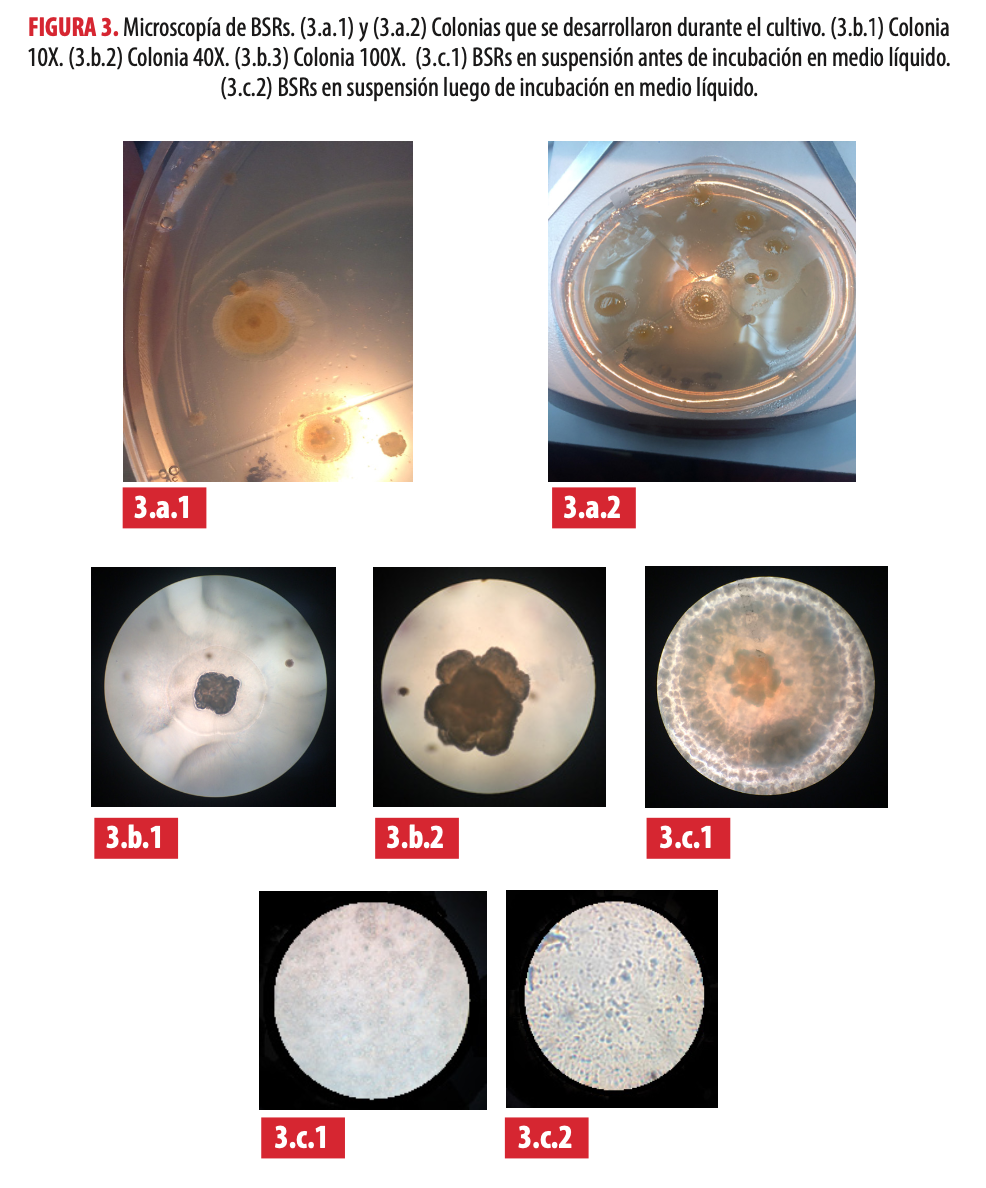
Microscopía de BSRs. (3.a.1) y (3.a.2) Colonias que se desarrollaron durante el cultivo. (3.b.1) Colonia 10X. (3.b.2) Colonia 40X. (3.b.3) Colonia 100X. (3.c.1) BSRs en suspensión antes de incubación en medio líquido. (3.c.2) BSRs en suspensión luego de incubación en medio líquido.
La Fig. 3 muestra las colonias de color negro-pardo y la recuperación cualitativa de estos organismos sembrados, incubados e inspeccionados dentro de la cámara respecto a la suspensión bacteriana (medio líquido). Tanto las colonias como las células observadas son consistentes con la morfología esperada de las BSRs.
Enumeración de BSRs por recuento en placa en diferentes muestras
La concentración de BSRs fue determinada en cuatro muestras: una suspensión bacteriana, lodos anaeróbicos enriquecidos, sedimentos de una laguna artificial, y una muestra de lodos provenientes de un biorreactor sulfato reductor durante la bioprecipitación de cobre (II); todas ellas fueron recolectadas o preparadas de forma independiente.
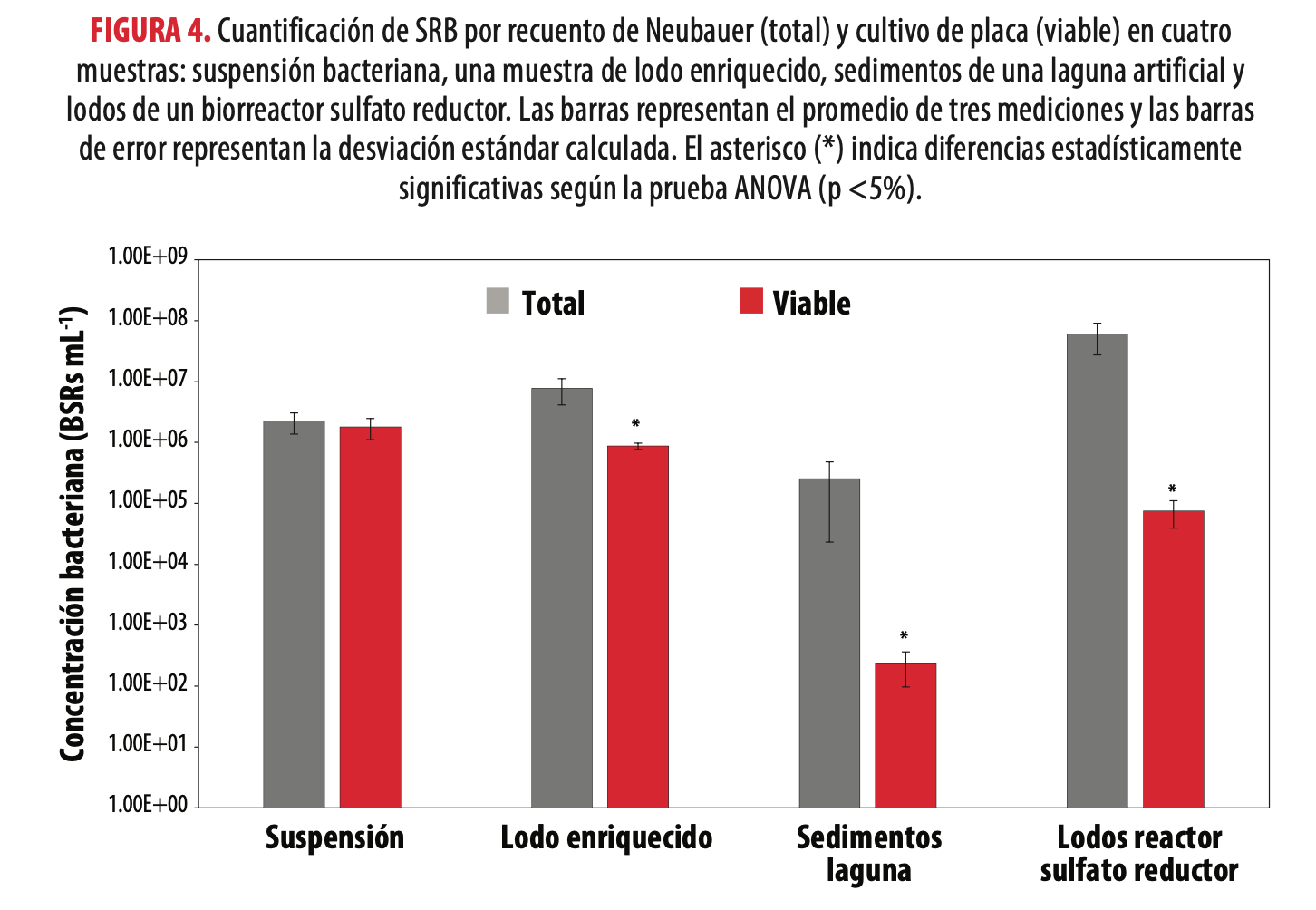
Cuantificación de SRB por recuento de Neubauer (total) y cultivo de placa (viable) en cuatro muestras: suspensión bacteriana, una muestra de lodo enriquecido, sedimentos de una laguna artificial y lodos de un biorreactor sulfato reductor. Las barras representan el promedio de tres mediciones y las barras de error representan la desviación estándar calculada. El asterisco (*) indica diferencias estadísticamente significativas según la prueba ANOVA (p <5%).
En la Fig. 4 se observa la concentración bacteriana determinada en cada muestra mediante la cámara de Neubauer (recuento total) y por cultivo en placa (recuento viable, UFC) empleando la cámara anaeróbica. La muestra de suspensión bacteriana registra valores de 1,79 x 106 células viables por mL y 2,21 x 106 células totales por mL por cultivo en placa y por conteo en cámara de Neubauer, respectivamente. Los lodos anaeróbicos enriquecidos tienen concentraciones bacterianas de 8,70 x 105 células viables por mL por cultivo en placa y 7,63 x 106 células totales por mL mediante conteo en cámara de Neubauer. En los sedimentos de la laguna artificial, 2,30 x 102 células viables por mL y 2,51 x 105 células totales por mL, por cultivo en placa y por conteo en cámara de Neubauer, respectivamente. Mientras que en los lodos provenientes de un biorreactor sulfato reductor durante la bioprecipitación de cobre (II), los resultados indican 7,48 x 104 células viables por mL por recuento en placa y 5,91 x 107 células totales por mL mediante conteo en cámara de Neubauer. De acuerdo a estos resultados, en la muestra de suspensión bacteriana los conteos de bacterias fueron estadísticamente similares por los dos métodos de cuantificación empleados (Fig. 4). Sin embargo, los recuentos bacterianos realizados en muestras de lodos, sean éstas de una laguna artificial, enriquecidos o de un biorreactor sulfato reductor presentaron diferencias significativas entre los dos métodos de conteo en cuestión; es decir, se produce una sobreestimación del recuento de bacterias utilizando el método de la cámara de Neubauer cuando se analiza muestras de este tipo en comparación con el conteo por cultivo en placa.
DISCUSIÓN
La cámara anaeróbica construida cumple con todos los requerimientos previamente establecidos (Fig. 1). El costo de construcción de la cámara anaeróbica es comparativamente menor (2.700 USD), si se considera que versiones comerciales, de características similares, tienen precios FOB de entre 12.000 y 15.000 USD. Además, esta cámara anaeróbica permite ejecutar las actividades de siembra y mantener las condiciones ambientales anaeróbicas deseadas durante todo el proceso de cultivo. Esto debido a que el espacio interior disponible es suficiente y a que las placas sembradas pueden ser periódicamente inspeccionadas, sin necesidad de que se comprometan las condiciones de cultivo, evitando así perturbar el lento crecimiento celular de las BSRs [19].
Durante la operación de la cámara anaeróbica se mantuvieron las condiciones óptimas de anaerobiosis y temperatura para el cultivo de las BSRs (Fig. 2); sin embargo, el sistema puede ser mejorado implementando un módulo automático de cambio de mezcla gaseosa al interior de la cámara anaeróbica, que será evaluado en el futuro.
Los resultados del presente estudio indican que microorganismos anaeróbicos estrictos han sido exitosamente cultivados en la cámara anaeróbica y que es apreciable su viabilidad (Fig. 3.), observándose colonias y células de bacterias capaces de crecer en anaerobiosis y en un medio de cultivo selectivo para BSRs [27]. Se recomienda realizar una identificación de especies mediante técnicas moleculares para confirmar la presencia de BSRs [23, 26].
Los valores reportados (Fig. 4) por recuento en placa para muestras similares, son similares a los reportados en la literatura utilizando la misma técnica analítica [14]. Cuando en la suspensión bacteriana se compara la concentración de BSRs obtenida por cultivo en placa (viable, UFC) versus la concentración celular determinada por la cámara de Neubauer, no hubo diferencia estadística significativa; mostrando que la fracción viable y el recuento total de células fueron similares (Fig. 4). Estos resultados sugieren que ambos métodos son válidos para la enumeración de BSRs en suspensiones bacterianas en fase exponencial de crecimiento. Adicionalmente, es razonable inferir que las condiciones ambientales al interior de la cámara fueron apropiadas para el crecimiento de los microorganismos anaeróbicos estrictos [6-7, 15].
Al contrario, el recuento total de BSRs en la muestra de lodos enriquecidos fue aproximadamente un orden de magnitud más alto que la concentración de colonias determinada por siembra y cultivo en placa (Fig. 4), y que la concentración total de BSRs fue significativamente mayor que la concentración de BSRs viables. Debido a que los lodos enriquecidos pueden contener partículas minerales y que estarían presentes otros microorganismos además de las BSRs, la determinación del número de células totales por el método de cámara de Neubauer es poco selectiva [29-30]. Otro factor a considerar es que este conteo directo fue realizado con iluminación de luz visible y sin colorantes de contraste que podrían haber permitido diferenciar los microorganismos de interés [25, 30].
Según el análisis de varianzas, en las muestras de lodos de la laguna artificial y del biorreactor sulfato reductor, los resultados de la enumeración por la cámara de Neubauer (total) y de recuento en placa (viable) fueron estadísticamente diferentes, lo que demuestra que también en estas dos matrices, la enumeración de BSRs por la cámara de Neubauer reporta valores significativamente superiores a los reportados por el método de siembra y recuento en placa (Fig. 4). Esto es atribuible a los motivos antes enunciados y a que en la cámara de Neubauer se contabilizan células vivas y muertas, o viables y no viables [30].
Finalmente, la construcción a bajo costo de una cámara anaeróbica de siembra y cultivo fue culminada exitosamente. En esta investigación se ha demostrado su operatividad de la cámara mediante el recuento en placa de BSRs, un grupo de microorganismos anaeróbicos estrictos; con la limitación de no haber realizado pruebas moleculares para su identificación. Los resultados experimentales obtenidos validan la eficiencia de la cámara construida para su uso en la siembra y cultivo de microorganismos anaeróbicos.
Agradecimientos
Los autores agradecen a César Zambrano, decano del Colegio de Ciencias e Ingenierías- El Politécnico-USFQ, por su apoyo a la realización de esta investigación. A la carrera de Ingeniería Ambiental, en especial a Esteban Tamayo. A Daniela Almeida Streitwieser, coordinadora de la carrera de Ingeniería Química y del grupo de investigación IDEMA, por su colaboración en la medición de la concentración de oxígeno al interior de la cámara. A Darío Ramírez y Noelia Barriga del Laboratorio de Biotecnología Agrícola y de Alimentos de la USFQ. Además, a Silvio León y al personal de Planta Física de la USFQ.
Esta investigación es parte del proyecto ID-816 “Análisis molecular de la diversidad bacteriana presente en biorreactores para el tratamiento de los drenajes ácidos de mina (DAM)”, liderado por Valeria Ochoa-Herrera y que fue financiado por la Universidad San Francisco de Quito (USFQ) a través del Chancellor’s Grant 2014 y del MiniGrant 2017 del Instituto de Microbiología. Esta investigación se llevó a cabo con el permiso número 30-2011-IC-FLO-DPAP / MA del Ministerio de Medio Ambiente de Ecuador.
Referencias
Kant Bhatiaa, S., Kant Bhatiaa, R., Choia, Y., Kand, E., Kime, Y. & Yanga, Y. (2018). Biotechnological potential of microbial consortia and future perspectives. Critical Reviews in Biotechnology Journal Critical Reviews in Biotechnology. 38 (8).
Hameed, S., Xie, L. & Ying, Y. (2018). Conventional and emerging detection techniques for pathogenic bacteria in food science: A review. Trends in Food Science & Technology 81(2018), 61-73.
Cox, M. & Magels, J. (1976). Improved Chamber for the Isolation of Anaerobic Microorganisms. Journal of Clinical Microbiology. 4(1), 40-45.
Stewart, E. J. (2012). Growing unculturable bacteria. J Bacteriol. 194(16), 4151-4160. Wagner, M. and Loy, A. (2002). Bacterial community composition and function in sewage treatment systems. Curr Opin Biotechnol. 13(1), 218-227.
Locey, K. & Lennon, J. (2016). Scaling laws predict global microbial diversity. Proceedings of the National Academy of Sciences. 113(21), 5970-5975.
Castro, H., Williams, N. & Ogram, A. (2000). Phylogeny of sulfate-reducing bacteria1. FEMS Microbiology Ecology. 31 (2000), 1-9
Ramell, F., Brasseur, G., Pieulle, L., Valette, O., Hirschler-Réa, A., Fardeau, M. & Dolla, A. (2015) Growth of the Obligate Anaerobe Desulfovibriovulgaris Hildenborough under Continuous Low Oxygen Concentration Sparging: Impact of the Membrane-Bound Oxygen PLOS One. DOI:10.1371/journal.pone.0123455.
Lens, P., Vallero, M., Esposito, G. & Zandvoor, M. (2003). Perspectives of sulfate reducing bioreactors in environmental biotechnology. Rev Environ Scie Biotechnol. 1, 311-325.
Muyzer, G. & Stams, A. (2008). The ecology and biotechnology of sulphate-reducing bacteria. Nat Rev Microbiol. 6, 441-454.
Agrawal, A. & Lal, B. (2009). Rapid detection and quantification of bisulfite reductase genes in oil field samples using real-time PCR. FEMS M. Ecology. 69(2), 301-312.
Cohen, R. (2006). Use of microbes for cost reduction of metal removal from metals and mining industry waste streams. J. of Cleaner Production. 14, 1146-1157.
St-Pierre, B. & Wright, G. (2017). Implications from distinct sulfate-reducing bacteria populations between cattle manure and digestate in the elucidation of H2S production during anaerobic digestion of animal slurry. Appl Microbiol Biotechnol. 101(13), 5543-5556.
Ingvorsen, K., Nielsen, M. & Joulian, C. (2003). Kinetics of bacterial sulfate reduction in an activated sludge plant. FEMS Microbio. Ecol. 46(2), 129-137.
Wakao, N. & Furusaka, Ch. (1972) A new agar plate method for the quantitative study of sulfate-reducing bacteria in soil. Soil Science and Plant Nutrition. 18(2), 39-44.
Choi, E. & Rim, J. (1991). Competition and inhibition of sulfate reducers and methane producers in anaerobic treatment. Wat. Sci. Tech. 23, 1259-1264.
Janssen, P., Yates, P., Grinton, E., Taylor, P. & Sait, M. (2002). Improved culturability of soil bacteria and isolation in pure culture of novel members of the divisions Acidobacteria, Actinobacteria, Proteobacteria, and Verrucomicrobia. Appl Environ Microbiol. 68(5), 2391-2396.
Zamora A. & Malaver, N. (2012). Methodological aspects for the culture and quantification of heterotrophic sulfatereducing bacteria. Revista de la Sociedad Venezolana de Microbiología. 32, 121-125.
Engelkirk, P., Duben-Engelkirk, J. & Dowell Jr., J. (1992). Principles and Practice of clinical anaerobic bacteriology. Belmont, CA: Star P.
Kendig, M. (2009). Design evaluation of an anaerobic chamber prototype A. Thesis presented to the Faculty of California Polytechnic State University, San Luis Obispo. In Partial Fulfillment of the Requirements for the Degree Master of Science in Biomedical Engineering.
Aranki, A., Syed, S., Kenney, E. & Freter, R. (1969). Isolation of Anaerobic Bacteria from Human Gingiva and Mouse Cecum by Means of a Simplified Glove Box Procedure. Department of Microbiology, The University of Michigan, Ann Arbor, Michigan 48104.
OSHA-a (2011). Laboratory Safety Guidance Occupational Safety and Health Administration U.S. Department of Labor OSHA 3404-11R 2011.
OSHA-b (2011). Laboratory Safety Ergonomics for the Prevention of Musculoskeletal Disorders. OSHA Factsheet.
Ochoa-Herrera, V., Q. Banihani, G. León, C. Khatri, J. A. Field & R. Sierra-Alvarez (2009). Toxicity of fluoride to microorganisms in biological wastewater treatment systems. Water Res. 43(13), 3177-3186.
Méndez, G., Ochoa-Herrera, V., Trueba, G. & Sierra-Alvarez, R. (2015). Molecular analysis of microbial diversity present in a sulfate-reducing bioreactor with a limestone pre-column system for the removal of copper. MS thesis, Institute of Microbiology. Universidad San Francisco de Quito, Ecuador.
Pérez, R., Cabera, G., Gómez, J., Abalos, A & Cantero, D. (2010). Combined strategy for the precipitation of heavy metals and biodegradation of petroleum in industrial wastewaters. J Hazard Mater. 182 (2010), 896-902.
Cotta, M., Whitehead, T. & Zeltwanger, R. (2003). Isolation, characterization and comparison of bacteria from swine faeces and manure storage pits. Environmental Microbiology. 5, 737-745.
Mohd Rasol, R., Yahaya, N., Noor, N., Abdullah, A. & Rashid, A. (2014). Mitigation of sulfate-reducing bacteria (SRB), Desulfovibrio vulgaris using low frequency ultrasound radiation. JCSE. 17, 1-17. ISSN 1466-8858.
Aström, K. & Hägglund, T. (1984). Automatic Tuning of Simple Regulators with Specifications on Phase and Amplitude Margins. Automatica. 20(5), 645-651.
Kogure, H., Simidu, U. & Taga, N. (1978). A tentative direct microscopic method for counting living marine bacteria. Journal of Microbiology. 25(1979), 415-420.
Anderson, K., Sallisp, P. & Uyanik, S. (2003). Anaerobic treatment processes. The Handbook of Water and Wastewater Microbiology. 24, 391-426.
Información adicional
CONTRIBUCIONES DE LOS AUTORES
:
Valeria Ochoa-Herrera concibió la investigación. Valeria Ochoa-Herrera administró
el proyecto y lideró la adquisición de fondos, recursos y equipos. Aracely Zambrano-
Romero y Nelson Herrera-Moreno diseñaron y supervisaron la construcción de la cámara
anaeróbica. Nelson Herrera-Moreno desarrolló el software de control de temperatura
y realizó el montaje de todas las partes eléctricas y electrónicas del equipo. Antonio
León-Reyes, Gabriel Trueba y Aracely Zambrano-Romero desarrollaron la metodología
experimental. Aracely Zambrano-Romero realizó los experimentos microbiológicos y análisis estadísticos. Valeria Ochoa-Herrera, Gabriel Trueba, Antonio León-Reyes y Reyes
Sierra-Álvarez realizaron la curación de datos para la investigación. Antonio León-Reyes
estructuró y definió el enfoque del manuscrito. Aracely Zambrano-Romero y Antonio
León-Reyes redactaron el manuscrito. Nelson Herrera-Moreno, Valeria Ochoa-Herrera y
Gabriel Trueba revisaron críticamente el contenido intelectual del manuscrito. Aracely
Zambrano-Romero realizó la producción de tablas, figuras y fotografías.