Impacto del procesamiento sobre los compuestos con propiedades antioxidantes de dos variedades de maíz (Zea mays L.)
Impact of processing on antioxidant properties compounds of raw and processed two varieties of corn
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
Recepción: 04 Septiembre 2018
Aprobación: 09 Noviembre 2018
Resumen: El maiz (Zea mays L.) constituye junto con el trigo y el arroz uno de los cereales importantes del mundo, suministra elementos nutritivos tanto a los seres humanos como a los animales y es materia prima básica para la industria alimenticia. Las variedades de color morado o negro además de presentar nutrientes contienen antioxidantes naturales que ayudan a reducir el riesgo de enfermedades cardiacas, respiratorias y a prevenir enfermedades degenerativas como el cáncer. El objetivo del presente estudio fue determinar el efecto del procesamiento en el contenido de compuestos y la actividad antioxidante del grano y raquis de las variedades de maíz: INIAP-199 y Sangre de Cristo. En estado crudo, el grano de INIAP-199 presentó el mayor contenido de fenoles (276.24 mg.100g-1) y antocianinas totales (241.97 mg.100g-1), zinc (3.72 mg.100g-1) y carotenoides (281.42 ug.100 g-1). Igualmente, en el raquis de esta variedad se registró un mayor contenido de flavonoides (210.73 mg.100 g-1), taninos (100.54 mg.100g-1) y ácido ascórbico (503.87 mg.100g-1). El extracto del raquis de INIAP-199 presentó un mayor poder antioxidante reductor férrico (1.92 mg.ml-1), este valor superó al extracto del grano (2.90 mg.ml-1). En los extractos del raquis y grano de la variedad Sangre de Cristo se registró una menor capacidad para reducir el ión férrico (6.59 y 6.92 mg.ml-1), lo cual podría guardar relación con la menor concentración de compuestos fenólicos en sus extractos. En general, el proceso de remojo afectó en menor grado a la concentración de compuestos con capacidad antioxidante del grano, el efecto contrario se determinó con el perlado, lo que hace suponer que los componentes con las mencionadas propiedades se concentran en el pericarpio del grano.
Palabras clave: Antioxidantes, Antocianinas, Fenoles, Flavonoides, Radicales libres.
Abstract: Maize, together with wheat and rice, is one of the most important cereals in the world. It supplies nutrients for both humans and animals. It is the basic raw material for the food industry. Purple or black varieties, in addition to nutrients, these contain natural antioxidants that help to reduce the risk of heart and respiratory diseases and prevent degenerative diseases such as cancer. The objective of the present study was to determine the effect of the processing in the compounds content and the antioxidant activity of the grain and crowns of the maize varieties: INIAP-199 and “Sangre de Cristo”. In the raw state, the grain of INIAP-199 had the highest total phenol content (276.24 mg.100g-1), total anthocyanins (241.97 mg.100g-1), zinc (3.72 mg.100g-1) and carotenoids (281.42 ug.100g-1). Likewise, the highest values of flavonoids (210.73 mg.100g-1), tannins (100.54 mg 100g-1) and ascorbic acid (503.87 mg.100g-1) were recorded in cobs of this variety. The cob extract of INIAP-199 presented high ferric reducing antioxidant power (1.92 mg.ml-1), this value exceeded the grain extract (2.90 mg.ml-1). “Sangre de Cristo” cobs and grain extracts had a lower capacity to reduce the ferric ion (6.59 and 6.92 mg.ml-1), which could be related to the low concentration of phenolic compounds in their extracts. In general, compounds concentrations with antioxidant capacity of grain were less affected by soaking, the opposite effect was determined with the pearling, which suggests that the compounds with the mentioned properties are concentrated in the husk ofthe grain.
Keywords: Antioxidants, Anthocyanins, Phenols, Flavonoids, Free radicals.
INTRODUCCIÓN
En la sierra ecuatoriana se han identificado 17 razas criollas de maíz, entre ellas se encuentran las variedades INIAP-199 y Sangre de Cristo, los cuales han sido cultivados por los agricultores, campesinos e indígenas de la sierra alto andina desde la época de la colonia hasta nuestro tiempo y lo vienen empleando para el consumo en fresco en la elaboración de bebidas y harinas [1].
En los últimos años países industrializados como Japón, Alemania y USA investigan el gran potencial en la utilización de variedades de color obscuro, como fuente de pigmentos naturales para alimentos y bebidas. La coloración morada o negra que presentan las plantas, corontas y pericarpio de los granos de maíz, son el resultado de una trabajo complejo realizado por muchos genes ubicados en diferentes cromosomas, lo que da como resultado la formación de pigmentos antociánicos de diferente color, los mismos que al combinarse forman el color púrpura [2]. La antocianina que se encuentra en mayor proporción en el maíz negro, es la cianidina-3- B-glucósido, que junto con otros compuestos como los carotenoides, la vitamina C, el zinc y los taninos, han sido valorados por sus propiedades antioxidantes [3]. Su función primordial es proteger al organismo del daño oxidativo que causan los radicales libres, los que alteran el buen funcionamiento de las células del organismo, atacando componentes estructurales claves de las mismas, como lípidos y proteínas de la membrana celular, enzimas e incluso al ADN, responsable del funcionamiento y renovación celular [4]. El daño oxidativo es el responsable de enfermedades de carácter degenerativo, cardiovasculares, cataratas, envejecimiento precoz y cáncer, todas las cuales actualmente son la principal causa de muerte [5]. El objetivo del presente estudio fue evaluar el impacto del procesamiento en la concentración de compuestos con propiedades antioxidantes del grano y raquis de dos variedades de maíz.
MATERIALES Y MÉTODOS
La presente investigación se desarrolló en el Instituto Nacional de Investigaciones Agropecuarias (INIAP), Estación Experimental “Santa Catalina, EESC”, localizada en la provincia de Pichincha, Cantón Mejía, Parroquia Cutuglagua. Se trabajó con el grano y el raquis de las variedades de maíz: INIAP-199 “racimo de uva” y “Sangre de Cristo”. La primera es una variedad semi tardía, su ciclo vegetativo está entre 240 a 260 días, su rendimiento varía de 2 a 4 t.ha-1, dependiendo del manejo agronómico y las condiciones ambientales. El método de mejoramiento utilizado para la generación de la variedad fue el mejoramiento poblacional, selección de Medios Hermanos (MH), modalidad familias mazorca por surco. La principal característica de esta variedad es el color morado obscuro de la mazorca y el grano, éste es de tipo redondo, semejante a un racimo de uva. La variedad “Sangre de Cristo”, es originaria de la provincia de Cotopaxi, su ciclo vegetativo está entre 260-270 días, su rendimiento es de 2.2 t.ha-1, el grano es alargado y de color rojizo [2]. Los dos materiales fueron proporcionados por el Programa de Maíz, EESC, con un contenido de humedad del 15%. Los procesos que se aplicaron tanto al grano como al raquis fueron: remojo en agua a 17 °C por 10 horas, cocción en agua a 91 °C por 1 hora, en olla abierta, cocción con vapor a 121 °C, 15 psi por 20 minutos, en un autoclave marca Webeco y perlado del grano en un equipo Strong Scott 07810, durante 2 minutos. Después de cada proceso, tanto el grano como el raquis fueron liofilizados en un equipo Labconco (-40 °C, -1 Barr), entonces el contenido de humedad de las muestras se redujo a 4.5%. Las muestras fueron molidas en un molino de cuchillas, marca Retsch GM 200, a un tamaño de partícula de 200 pm, luego se envasaron en recipientes herméticos y se almacenaron a 5 °C, hasta los análisis químicos. Las determinaciones espectrofotométricas, excepto el Zinc, se realizaron en un espectrofotómetro UV-Visible, Evolution 201, marca Thermo Scientific. En estado crudo y procesado, se cuantificó los siguientes compuestos químicos:
Fenoles totales
El método de determinación se basa en que los compuestos fenólicos reaccionan con el reactivo Folin-Ciocalteu, a pH básico, dando lugar a una coloración azul susceptible de ser determinada espectrofotométricamente a 765 nm. Este reactivo contiene una mezcla de wolframato sódico y molibdato sódico en ácido fosfórico que reaccionan con los compuestos fenólicos presentes en la muestra. El ácido fosfomolibdotúngstico (formado por las dos sales en medio ácido) de color amarillo, al ser reducido por los grupos fenólicos da lugar a un complejo de color azul, cuya intensidad se mide para evaluar el contenido en fenoles totales. Esta prueba es específica para fenoles totales. La diferenciación más pequeña de absorbancia para la prueba es 0.010 unidades de absorbancia. Esta corresponde a 1g de ácido gálico de solución de la muestra a un volumen máximo de 1 ml. El límite de detección es 1 g de ácido gálico. La prueba es lineal en el rango 5 a 100 g de ácido gálico por prueba. Para determinaciones en duplicado usando una solución de la muestra, la diferencia en la absorbancia es de 0.005 a 0.010.
Con un volumen de muestra de 1 ml, esto corresponde a una concentración de ácido gálico de aproximadamente 0.05 a 1 mg.ml-1 de solución de muestra. Si la muestra es diluida durante su preparación, el resultado se multiplica por el factor de dilución [6]
Flavonoides totales
La determinación se basa en la reacción de coloración de estos compuestos con tricloruro de aluminio; el complejo formado presenta absorbancia en el espectro ultravioleta, por lo que puede ser cuantificado mediante la técnica de espectrofotometría UV-visible. Esta prueba es específica para flavonoides totales. La diferenciación más pequeña de absorbancia para la prueba es 0.008 unidades de absorbancia. Esta corresponde a 1g de quercetina de solución de la muestra a un volumen máximo de 1 ml. El límite de detección es 1 g de quercetina. La prueba es lineal en el rango 2 a 100 g de quercetina por prueba. Para determinaciones en duplicado usando una solución de la muestra, la diferencia en la absorbancia es de 0.005 a 0.010. Con un volumen de muestra de 1ml, esto corresponde a una concentración de quercetina de aproximadamente 0.05 a 1 mg.ml-1 de solución de muestra. Si la muestra es diluida durante su preparación, el resultado se multiplica por el factor de dilución [7].
Antocianinas totales
La cuantificación se realizó por el método de pH diferencial, el cual se basa en la transformación estructural de las antocianinas con el cambio de pH. La extracción de antocianinas totales se realiza con una solución de etanol y HCl mientras que la cuantificación se realiza espectrofotométricamente. Se realizó un barrido espectral de 400 a 700 nm [8]. Se estableció una correlación lineal significativa entre los valores de la concentración y la absorbancia, puesto que el valor de tc (168.285) calculado es superior al valor t obtenido de tablas (3.18) con un 95% confianza.
Taninos
La determinación se realizó a partir de un extracto acuoso, el cual reacciona con el reactivo Folin-Denis en medio alcalino. Se utilizó acido tánico como estándar y se realizaron las lecturas en un espectrofotómetro UV- VIS a 680 nm. Esta prueba es específica para taninos totales. La diferenciación más pequeña de absorbancia para la prueba es 0.010 unidades de absorbancia. Esta corresponde a 1g de ácido tánico de solución de la muestra a un volumen máximo de 1 ml. El límite de detección es 1g de ácido tánico. La prueba es lineal en el rango 1 a 50 g de ácido tánico por prueba. Para determinaciones en duplicado usando una solución de la muestra, la diferencia en la absorbancia es de 0.005 a 0.010. Con un volumen de muestra de 1ml, esto corresponde a una concentración de ácido tánico de aproximadamente 0.005 a 1 mg.ml-1 de solución de muestra. Si la muestra es diluida durante su preparación, el resultado se multiplica por el factor de dilución [9].
Ácido ascórbico
Se determinó por espectrofotometría. En este método, el ácido ascórbico de la muestra reacciona con el 2.6 dicloroindofenol (2.6 DCIP) y lo reduce. Conforme el 2.6 DCIP es reducido, su coloración azul característica disminuye hasta rojo. El cambio de coloración es registrado a 520 nm y la concentración de ácido ascórbico de la muestra se calcula usando una curva de calibración que emplea el L-ácido ascórbico como estándar. Esta prueba es específica para ácido ascórbico. La diferenciación más pequeña de absorbancia para la prueba es 0.010 unidades de absorbancia. Esta corresponde a 1 g de ácido L-ascórbico de solución de la muestra a un volumen máximo de 1 ml. El límite de detección es 1 g de ácido L-ascórbico. La prueba es lineal en el rango 5 a 200 g de ácido L-ascórbico por ml. Para determinaciones en duplicado usando una solución de la muestra, la diferencia en la absorbancia es de 0.005 a 0.010. Si la muestra es diluida durante su preparación, el resultado se multiplica por el factor de dilución [10].
Zinc
Las muestras fueron incineradas y luego sometidas a digestión ácida, el digerido se aforó a 100 ml y se realizó el análisis de zinc [10]. Se realizó una curva de calibración, con los valores obtenidos de la lectura del estándar (concentración vs. absorbancia). Los valores de absorbancia se midieron en un espectrofotómetro GFA-7000, marca Shimadzu, se interpolaron en la curva de calibración, considerando la respectiva dilución. Se estableció un valor de pendiente de la curva (0.0042) y de la ordenada en el origen (0.0124). Se determinó que los valores de la desviación estándar de la pendiente y desviación estándar de la ordenada en el origen, corresponden a 0.01 y 0.572, respectivamente. Con base a estos datos, se establecieron los límites de confianza con un 95% de significación mediante el parámetro estadísticos “t student”
Carotenoides totales
Se determinó espectrofotométricamente a 450 nm, basados en el coeficiente de extinción (E1%) de estos compuestos en éter de petróleo. La extracción se realiza con acetona y para la determinación se transfieren los carotenoides a éter de petróleo previa saponificación, la cual ayuda a liberar los carotenoides esterificados. La cuantificación de carotenoides totales se realiza por espectrofotometría a 450 nm, usando el coeficiente de absorción recomendado para mezclas de carotenoides (2500). Esta prueba es específica para carotenoides totales. La diferenciación más pequeña de absorbancia para la prueba es 0.010 unidades de absorbancia. Esta corresponde a 1g de carotenoides totales de solución de la muestra a un volumen máximo de 1 ml. El límite de detección es 1 g de carotenoides totales. Para determinaciones en duplicado usando una solución de la muestra, la diferencia en la absorbancia es de 0.005 a 0.010. Con un volumen de muestra de 1 ml, esto corresponde a una concentración de carotenoides totales de aproximadamente 0.01 a 1 mg.ml-1 de solución de muestra. Si la muestra es diluida durante su preparación, el resultado se multiplica por el factor de dilución [11].
Capacidad antioxidante
El análisis se basa en el poder reductor de un antioxidante que reduce el ion férrico (Fe3+) a ion ferroso (Fe2+). De este modo se genera una coloración de intensidad proporcional a la actividad reductora de la muestra. La capacidad para reducir el hierro se considera un índice del poder antioxidante de la muestra. El poder reductor de los extractos guarda una relación directa con el valor de la absorbancia. En este método conocido como FRAP, el valor EC50 (mg extracto.ml-1) es la concentración efectiva a la cual la absorbancia es la mitad del poder reductor, por lo que valores inferiores a 10 mg.ml-1 se traducen en una mejor capacidad antioxidante. En esta prueba la diferenciación más pequeña es 0.010 unidades de absorbancia. Esta corresponde a 1 mg de extracto de la muestra aforado a un volumen de 1 ml. El límite de detección es 1 mg de cloruro férrico. La prueba es lineal en el rango 1 a 50 mg.ml-1 por prueba. Para determinaciones en duplicado usando una solución de la muestra, la diferencia en la absorbancia es de 0.005 a 0.010. Si la muestra es diluida durante su preparación, el resultado se multiplica por el factor de dilución [12].
Análisis estadístico
El análisis estadístico se realizó en el Programa InfoStat [13]. La distribución normal de los datos se verificó a través de la prueba de bondad de ajuste de Shapiro-Wilks. Para el análisis de resultados relacionados con los compuestos y propiedades antioxidantes del grano y raquis en estado crudo, se aplicó un diseño completamente al azar (DCA), con tres repeticiones. Para las variedades procesadas se aplicó un DCA en arreglo factorial 2x2x4 con tres repeticiones.
RESULTADOS
Se determinó diferencias significativas en el contenido de fenoles totales, flavonoides, antocianinas totales, taninos, ácido ascórbico, zinc y carotenoides totales del grano y raquis entre las dos variedades de maíz, en estado crudo. Los mayores contenidos de estos compuestos se registraron en el grano y raquis de la variedad INIAP-199, a excepción de los carotenoides totales del raquis, que se presentaron en mayor concentración en la variedad Sangre de Cristo (63.32 p g.100 g-1). El análisis comparativo realizado entre el grano y el raquis de INIAP-199, determina que en estas últimas se presentó un mayor contenido de compuestos con propiedades antioxidantes (flavonoides, antocianinas, taninos y ácido ascórbico) mientras que en el grano predominaron los fenoles totales, el zinc y carotenoides, como se muestra en la “Tabla 1”. Estos resultados incidieron en la mayor capacidad antioxidante tanto del raquis como del grano de INIAP-199, como se muestra en la “Tabla 2”.
| Grano | Raquis | |||
| Compuesto (mg.100 gr1, base seca) | INIAP-199 | Sangre de Cristo | INIAP-199 | Sangre de Cristo |
| Fenoles totales | 276.24 ± 1.80a | 245.83 ± 0.90d | 270.82 ± 1.80b | 260.86 ± 1.80c |
| Flavonoides | 200.91 ± 1.40b | 10.13 ± 0.07d | 210.73 ± 1.40a | 77.73 ± 0.40c |
| Antocianinas totales | 426.72 ± 12.90b | 32.38 ± 0.10d | 1052.60 ± 11.60a | 65.04 ± 1.20c |
| Taninos | 69.90 ± 0.20b | 7.64 ± 0.20d | 100.54 ± 0.40a | 33.14 ± 0.20c |
| Ácido ascórbico | 117.58 ± 0.10c | 104.01 ±0.10d | 503.87 ± 0.10a | 260.61 ± 0.10b |
| Zinc | 3.72 ± 0.20a | 2.72 ± 0.20b | 2.98 ± 0.20b | 2.80 ± 0.20b |
| Carotenoides totales (p g.100 g-1) | 281.42 ± 6.60a | 85.45 ± 6.60b | 55.03 ± 6.60c | 63.32 ± 6.50c |
Contenido de compuestos con propiedades antioxidantes en dos variedades de maíz, en estado crudo.
Los datos representan la media de tres determinaciones. Las medias con letras diferentes en una misma fila indican diferencias significativas (p<0.05)
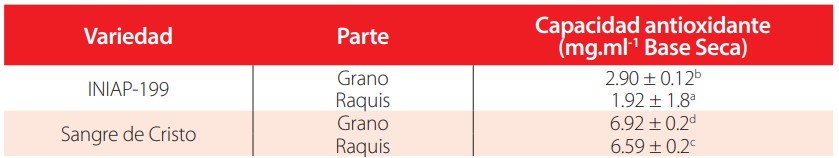
Capacidad antioxidante de dos variedades de maíz en estado crudo
Los datos representan la media de tres determinaciones. Las medias con letras diferentes en la misma columna indican diferencias significativas (p<0.05).
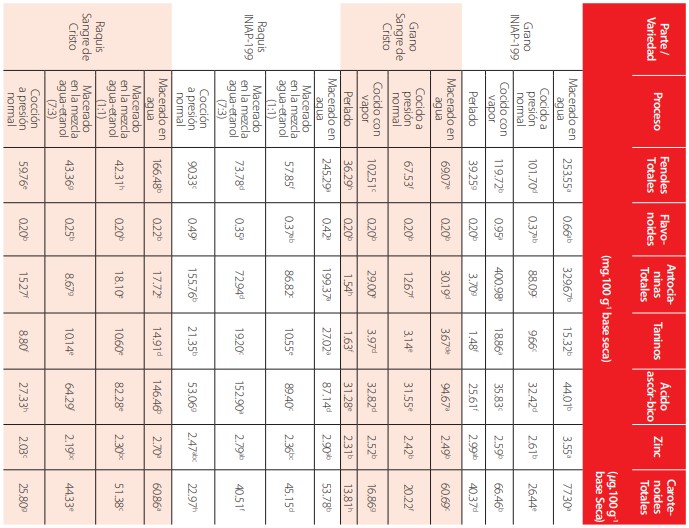
Efecto del procesamiento en el contenido de compuestos antioxidantes de dos variedades de maíz
Los datos representan la media de tres determinaciones. Superíndices diferentes en una misma columna indican diferencias significativas (p<0.05)Las diferentes condiciones de procesamiento afectaron a los compuestos químicos del grano y el raquis, por lo que se determinaron diferencias significativas en los compuestos antioxidantes evaluados (Tabla 3). El zinc fue el componente que experimentó menos pérdidas durante el procesamiento del grano y el raquis; en contraste los flavonoides sufrieron las mayores pérdidas, al igual que el ácido ascórbico, los fenoles totales y antocianinas, lo que influyó en la disminución de la capacidad antioxidante de los materiales procesados, con relación a los crudos como se observa en la “Tabla 4”.
| Variedad | Componente | Proceso | Capacidad antioxidante (mg. ml-1) |
| INIAP-199 | Grano | Remojo en agua | 6.37a |
| Cocido a presión normal | 26.13g | ||
| Cocido a vapor | 8.63b | ||
| Raquis | Remojo en agua | 13.40c | |
| Remojo en la mezcla agua (50%)-etanol (50%) | 16.61c | ||
| Remojo en la mezcla agua (70%)-etanol (30%) | 16.97c | ||
| Cocido a presión normal | 21.90d | ||
| Sangre de Cristo | Grano | Remojo | 18.29d |
| Cocido a presión normal | 19.54d | ||
| Cocido a vapor | 23.42f | ||
| Perlado | 28.02h | ||
| Raquis | Remojo en agua | 22.70e | |
| Remojo en la mezcla agua (50%)-etanol (50%) | 24.50f | ||
| Remojo en la mezcla agua (70%)-etanol (30%) | 25.37g | ||
| Cocido a presión normal | 30.02h |
Efecto del procesamiento en la capacidad antioxidante de dos variedades de maíz.
Los datos representan la media de tres determinaciones. Superíndices diferentes en una misma columna indican diferencias significativas (p<0.05).DISCUSIÓN
En estado crudo, el grano y el raquis de la variedad INIAP-199, presentaron el mayor contenido de compuestos con propiedades antioxidantes, con relación a la variedad “Sangre de Cristo”. Para los fenoles totales se registró 276.24 mg acido gálico.100g-1, en el grano y 270.82 mg.100g-1 en el raquis; estos valores son similares a los reportados por otros autores [15-16].
Los flavonoides, las antocianinas totales, los taninos y el ácido ascórbico se presentaron en mayor concentración en el raquis de INIAP-199, con valores de 210.73mg quercetina.100g-1, 1052.60 mg.100g-1, 100.54 mg.100g-1 y 503.87 mg.100g-1, respectivamente; mientras que en el grano se registraron los siguiente contenidos: flavonoides totales 200.91 mg.100 g-1, antocianinas 426.72 mg.100 g-1, taninos 69.90 mg.100g-1 y para el ácido ascórbico 117.58 mg.100g-1. Estos valores se enmarcan en el rango reportado por varios autores [16]. El zinc y los carotenoides totales también sobresalieron en el grano de INIAP-199, con valores de 3.72 mg.100g-1 y 281.42 µg.100g-1. Sin embargo, el contenido de zinc, es menor que el valor reportado por otros autores para especies, como el sangorache (Zinc, 4.59 mg.100g-1) [15]. En cuanto, a la capacidad antioxidante, el raquis de la variedad INIAP-199, presentó el mayor valor (1.92 mg.ml-1), lo cual se correlacionó con la mayor concentración de compuestos antioxidantes en esta fracción de la planta. Los estudios realizados por varios investigadores muestran la participación específica de los flavonoides en la actividad antioxidante de los vegetales e indican que la naturaleza química de estos compuestos ayuda a predecir su actividad estabilizante de radicales libres, debido a que los potenciales reductores de sus radicales son más bajos que aquellos de los radicales peroxilos y superóxido, lo que significa que estos metabolitos secundarios pueden inactivar dichas especies pro-oxidantes y prevenir así sus efectos dañinos [16-19]. El procesamiento provocó una pérdida sustancial de todos los compuestos referidos en este estudio. Los fenoles totales del grano disminuyeron un 70% por efecto del perlado, lo que hace suponer que estos compuestos se localizan en el epicarpio y mesocarpio del grano, componentes que se eliminaron durante la operación de perlado.
Una pérdida del 50.47% de fenoles totales, se determinó en el raquis de INIAP-199, maceradas en una solución hidro-etanólica en proporción 1:1, lo cual refleja la solubilidad de estos compuestos en solventes polares y el grado en el cual pueden estar esterificados y/o glicosilados. La maceración acuosa, fue el proceso menos deletéreo para los compuestos antioxidantes tanto del grano como de las corontas en relación a los materiales cocidos y perlados. En los primeros coadyuva el efecto de la temperatura y en los segundos el desprendimiento del pericarpio. En general, los flavonoides, taninos, ácido ascórbico y carotenoides totales experimentaron pérdidas entre 50% a 80% por efecto de los procesos aplicados. El zinc, fue el compuesto más estable en el procesamiento, registrándose pérdidas del 4.56% y 2.68% en la maceración acuosa del grano y raquis, respectivamente.
La cantidad de antioxidante necesaria para reducir en un 50% la cantidad de radicales libres IC50 para las corontas de INIAP-199 fue 1.92 mg.ml-1. Según el método FRAP, valores inferiores a 10 mg.ml-1 se traducen en una mejor capacidad antioxidante. En general los extractos metanólicos de la variedad INIAP-199 (grano y raquis), presentaron una mayor capacidad antioxidante que los extractos de grano y corontas de la variedad Sangre de Cristo con 6.92 mg.ml-1 y 6.59 mg.ml-1. Entre los procesos de cocción, la operación con vapor preservó un mayor contenido de compuestos bioactivos; en la cocción a presión normal se determinó una mayor pérdida, atribuible a la hidrosolubilidad y termolabilidad de la mayoría de compuestos considerados en este estudio [20].
El proceso de menor afectación en la capacidad antioxidante fue la maceración acuosa del grano de INIAP-199, para cuyos extractos, se determinó un valor de 6.37 mg.ml-1, concentración efectiva a la cual la absorbancia fue la mitad del poder reductor.
En conclusión, se analizaron los compuestos funcionales de dos variedades de maíz y las actividades antioxidantes de sus extractos. Se determinó que existe una relación general entre el contenido de fenoles totales, flavonoides, antocianinas totales, taninos, ácido ascórbico, zinc y el nivel de actividad antioxidante relativa. El raquis de la variedad INIAP-199, en estado crudo, mostró mayor cantidad de los mencionados compuestos y consistentemente exhibe la mayor capacidad antioxidante (1.92 mg.ml-1). Esta fracción de la planta es objeto de estudios más profundos sobre su efecto potencial como promotor de la salud, así como de la identificación de los compuestos fenólicos responsables de las actividades antioxidantes. De los procesos tecnológicos considerados en este estudio, se destaca que la maceración acuosa a 17 °C afecta en menor grado a los compuestos y actividad antioxidante, con relación a los procesos de cocción en los que coadyuva la temperatura y la pérdida de compuestos localizados en el pericarpio en la operación de perlado del grano.
Agradecimientos
A la Secretaria de Educación Superior, Ciencia, Tecnología e Innovación (SENESCYT), por el apoyo financiero para realizar la presente investigación. Al Instituto Nacional de Investigaciones Agropecuarias INIAP- Programa de Maíz, (Estación Experimental Santa Catalina), por la provisión oportuna de las variedades de maíz para realizar el estudio. Un resumen del presente trabajo se presentó en la XXII Reunión latinoamericana de Maíz.
Referencias
Y ánez, C. (2003). Informe final del proyecto IQ-CV-046: Manejo de los Recursos Genéticos de maíz. INIAP. Quito, Ecuador.
Yánez, C., Zambrano, J., Caicedo, M., Heredia, J., Sangoquiza, C., Villacrés, E., Racines, M., Caballero, D. (2016). Ficha Técnica de la Variedad de maíz negro INIAP-199 “Racimo de Uva”. Quito, Ecuador: INIAP, Estación Experimental Santa Catalina, Programa de Maíz.
Yoshida, K., Y. Sato, R. Okuno, K. Kameda, M. Isobe, and T. Kondo (1996). Structural analysis and measurements of anthocyanins from coloured seed coats of Vignia, Phaseolus and Glycine legumes. Biosci. Biotech. Biochem. 60(4): 589593.
Martinez, A., Naranjo, A., Nungaray, J. (2003). Antocianinas, flavonoides y ácidos fenólicos presentes en frijol negro Querétaro y Mayocoba y su estabilidad durante el cocimiento industrial. Recuperado de http://www.smbb.com.mx/congresos%20smbb/puertovallarta03/trabajos/area_vi/cartel/cvi-2
Joshua, D., Lambert, Chung S. Yang (2003). Cancer chemopreventive activity and bioavailability of tea and tea polyphenols. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. Volumes 523-524: 201-208.
Garry G. Duthiea, Susan J. Duthiea and Janet A. M. Kylea (2000). Plant polyphenols in cáncer and heart disease: implications as nutritional antioxidants. Nutrition Research Reviews: 79-106.
Taga, M., Miller, E. E., Pratt, D. E. (1987). Chia seeds as a source of natural lipid antioxidants. Journal of American Oil Chem. Society, 61: 928-931.
Quettier-Deleu, C., Gressier, B., Vasseur, J., Dine, T., Brunet, C., Luyckx, M., et al. (2000). Phenolic compounds and antioxidant activities of buckwheat (Fagopyrum esculentum Moench) hulls and flour. Journal of Ethnopharmacology, 35-42.
Giusti, M., Wrolstad, R. (2001). Characterization and measurement of anthocyanins by UV-visible spectroscopy. In R.Wrolstad, T. Acree, H. An, E. Decker, M. Penner, D. Reid, S. Schwartz, C. Shoemaker, P. Sporns (Eds.), Current Protocols in Food Analytic Chemistry. New York: Wiley.
A.O.A.C. (2000). Manual on Polices and Procedures. Association of Official Analytical Chemist. Arlington, Estados Unidos.
Klein, B., & Perry, A. K. (1982). Ascorbic acid and vitamin A activity in selected vegetables from different geographical areas of the United States. Journal of Food Science 47: 941-948.
Rodríguez, Amaya, Mieko Kimura., (2004). Havastplus, Handbook for carotenoid analysis. Harvest Plus Technical Monograph 2. Washington, DC and Cali. International Food Policy Research Institute (IFPRI) and International Center for Tropical Agriculture (CIAT). Procedures for nutrient analysis in potato and sweet potato. Nutrition and Quality Laboratory - CIP.
Di Rienzo, J., Casanoves, F., Balzarini, M., Gonzales, L., Robled, C. (2016). InfoStat versión 2015 (computer Program). Grupo InfoStat. Universidad Nacional de Córdoba, Argentina.
Oyaizu, M. (1986). Studies on products of the browning reaction: Antioxidative activities of browning reaction products prepared from glucosamine. Japanese Journal of Nutrition 44: 307-315.
Tanquina, I. (2013). Efecto de la especie y el procesamiento sobre el contenido de compuestos y propiedades antioxidantes del maíz (zea mays l.) negro, frejol (phaseolus vulgaris l.) negro, sangorache (amaranthus de papas nativas (tuberosum grupo andigenum). (Tesis de Ingeniería). Universidad Técnica de Ambato. Ambato, Ecuador.
Rmj Mex-Alvarez, Nj Bolívar-Fernández, PM Garma-Quen, Ja Tut-Heredia & Ki Romero-Guil. (2013). Actividad antioxidante de cinco variedades de maíz, cultivadas en Campeche, México.(págs. 558-569). Recuperado de http://www.redalyc.org/html/856/85629226001/
López-Martínez, L., García-Galindo, H. (2009). Actividad antioxidante de extractos metanólicos y acuosos de distintas variedades de maíz mexicano. Ciencias Naturales e Ingenierías, Guanajuato, México.
Giraldo, B., Hernández, M. M., Angulo, P. & Fuertes, C. (2003). Actividad antinitrosativa y antiinfl amatoria de los fl avonoides de las hojas de Uncaria tomentosa Willd. D.C. (Uña de gato). Rev. Soc. Quím. Perú. 69 (4): 229-242.
Murillo, E., Tique, M .M., Ospina, L F. & Lombo Ó. (2006). Evaluación preliminar de la actividad hipoglicemiante en ratones diabéticos por aloxano y capacidad antioxidante in vitro de extractos de Bauhinia kalbreyeri Harms. Rev. Col. Cienc. Quím. Farm. 35: 64-80.
Kähkönen, Marja; Anu I. Copia; Heikki J. Vuorela; Jussi- Pekka Rauha; Kalevi Pihalaja; Tutti S. Kujala and Marina Heinonen (1999). Antioxidant activity of plant extracts containing phenolic compounds. J. Agric. Food Chem. 47: 954962.
Dinis, T., Madeira, V., Almerida, L.(1994). Action of Phenolics derivatives (acetaminophen, salicylate and 5-aminosalicylate) as inhibitors of membrane lipid peroxidation and as peroxyl radical scavengers. Archives of Biochemistry and Biophysics 315: 161-169.
Shimada, K., Fujikawa, K., Yahara, K., Nakamura, T. (1992). Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion. Journal of Agricultural and Food Chemistry 40: 945-948.
Información adicional
CONTRIBUCIÓN
DE LOS AUTORES: Elena Villacrés; mentalizó la investigación, diseñó los experimentos,
redactó el manuscrito y participó como tutor y revisor de los resultados. Irma
Tanquina realizó los ensayos de laboratorio, la toma de datos y análisis
estadístico de resultados. María Belén Quelal participó en la validación de las
metodologías aplicadas. Javier Alvarez, contribuyó en el desarrollo de ensayos
de laboratorio. Carlos Yánez participó en la verificación del análisis
estadístico de resultados. Milton Ramos contribuyó en la revisión de los
resultados de la investigación.