Evaluación de la resistencia genética de híbridos de maíz al virus del mosaico de la caña de azúcar (SCMV)
Evaluation of maize hybrids to Sugarcane mosaic virus (SCMV)
ACI Avances en Ciencias e Ingenierías
Universidad San Francisco de Quito, Ecuador
Recepción: 04 Junio 2018
Aprobación: 24 Agosto 2018
Resumen: La resistencia genética es la manera más eficiente de controlar las enfermedades ya que no tiene un costo adicional para el agricultor y no contamina el ambiente. Un cultivo de maíz sano es la regla, la excepción es la enfermedad. El primer paso en todo programa de mejoramiento genético para incorporar resistencia al cultivo es identificar materiales resistentes entre las variedades tradicionales y comerciales, poblaciones mejoradas de alta diversidad genética (pooles), colecciones núcleo y colecciones para estudios genéticos. Para esto es necesario realizar evaluaciones en condiciones controladas donde se inocula el patógeno y se le brindan las condiciones para que la planta se enferme. En caso de enfermedades virales, las técnicas de inoculación incluyen el frotamiento, punción vascular y la utilización de los vectores naturales que transmiten el virus. Sugarcane mosaic virus (SCMV) está entre los principales virus que afectan al cultivo de maíz en los valles altos y trópicos de Latinoamérica y alrededor del mundo. En la Estación Experimental Litoral Sur del INIAP se inocularon 32 híbridos comerciales y experimentales de maíz utilizando la técnica del frotamiento en plántulas, con un aislamiento de SCMV colectado en la Estación Experimental Portoviejo del INIAP. Dos semanas después de la inoculación se evaluó la incidencia de los síntomas de la enfermedad en las hojas nuevas. El experimento tuvo tres réplicas biológicas en un diseño completo al azar, con 20 plantas por tratamiento. No existieron híbridos resistentes, lo que indica la necesidad de incorporar genes de resistencia a SCMV en las poblaciones de mejoramiento genético de maíces tropicales de grano amarillo duro de las empresas públicas y privadas.
Palabras clave: Fitomejoramiento de maíz, Fitopatología.
Abstract: OPEN ACCESS Genetic resistance is the most efficient way to control diseases because it does not have an additional cost for the farmer and it does not pollute the environment. A healthy maize crop is the rule, the exception is the disease. The first step in any breeding program to incorporate genetic resistance is the identification of resistant genotypes among traditional and commercial varieties, improved populations of high genetic diversity (pools) and core collections. For this, it is necessary to carry out evaluations in controlled conditions where the pathogen is inoculated. In case of viral diseases, inoculation techniques include the rubbing technique, vascular puncture inoculation, and the utilization of the natural vectors to transmit the virus. Sugarcane mosaic virus (SCMV) is among the main viruses that affect maize in the highlands and tropical valleys of Latin America and worldwide. In the Experimental Station Litoral Sur of INIAP, seedlings of 32 commercial and experimental maize hybrids were inoculated using the rubbing technique with a SCMV isolate collected in the Experimental Station Portoviejo of INIAP. Two weeks after the inoculation, the incidence of symptoms of the disease was evaluated. The experiment had three biological replicates in a randomized design, with 20 plants per treatment. All the tested hybrids were susceptible to the virus, which indicates the need to incorporate genetic resistance to SCMV in the breeding programs of tropical maize.
Keywords: Maize breeding, Plant pathogen.
INTRODUCCIÓN
La enfermedad viral en un cultivo de maíz es la excepción a la regla. La planta se enferma cuando existen varias condiciones que rompen el equilibrio normal del cultivo. Para que exista una epidemia viral se requiere que los siguientes factores confluyan todos al mismo tiempo en el mismo lugar: a) la presencia del virus, b) condiciones ambientales favorables para el desarrollo del virus, c) un hospedero o planta de maíz susceptible, y d) el vector que transmita la enfermedad. Cuando estos factores ocurren en un mismo lugar los virus pueden afectar severamente el cultivo y causar importantes pérdidas al rendimiento, como los reportados en China, Kenia, Ruanda y Ecuador [1-4].
Entre los síntomas más comunes de las enfermedades virales en maíz están la clorosis en las hojas en forma de rayas, bandas, o mosaicos irregulares, plantas con visible achaparramiento o enanismo, mazorcas pequeñas con irregular llenado de grano, y en ciertas ocasiones la muerte de la planta.
En el Ecuador existen varios virus reportados en maíz. Vázquez y Mora reportaron la incidencia y pérdidas causadas por el Maize rayado fino virus (MRFV) en la Provincia de Imbabura [5]. Recientemente, Quito-Avila y colegas reportaron la presencia de la enfermedad conocida como necrosis letal del maíz en la Provincia de Manabí, que es causada por la interacción de dos virus: Sugarcane mosaic virus (SCMV) y Maize chloroticmottle virus (MCMV) [4].
En el continente americano, los virus de mayor importancia por la incidencia y las pérdidas que estos causan en maíz son los Potyvirus: Maize dwarf mosaic virus (MDMV) y SCMV. Así mismo, la resistencia genética del maíz a estos virus son los más estudiados a nivel mundial [6]. Le sigue el Maize rayado fino virus (MRFV) de importancia en Centro América y en la zona andina por su incidencia y el daño ocasionado al cultivo [7]. Maize mosaicvirus (MMV) es de relativamente menor importancia, existiendo reportes esporádicos del virus en Estados Unidos (Hawai) y Venezuela [8].
Para todos los virus anteriormente descritos existe resistencia genética disponible en ciertos genotipos de maíz, sin embargo no siempre la resistencia está disponible en los cultivares comerciales [9]. Las bases genéticas de la resistencia a virus han sido relativamente mejor estudiadas, sobre todo en lo referente a los Potyvirus, habiéndose identificado resistencia cualitativa y cuantitativa en varios genotipos [10,11]. A nivel genómico se han identificado regiones (QTLs) en los cromosomas dos, tres, seis y diez responsables por la resistencia a varias enfermedades virales, en un aparente cluster o agrupamiento de genes, o genes con efectos pleiotrópicos [12].
De entre los métodos de control o prevención de las enfermedades virales, la más efectiva y económicamente rentable para el agricultor es la resistencia genética, ya que el agricultor no requiere de ningún esfuerzo o gasto adicional para evitar o aplacar el daño que estas enfermedades puedan causar en su cultivo. Existen varios métodos que pueden usar los programas de mejoramiento genético para desarrollar variedades o líneas con resistencia a enfermedades virales [9]. El mejor método combina la selección asistida por marcadores moleculares con evaluaciones realizadas en ambientes controlados inoculando el virus. La identificación de genotipos con resistencia a la enfermedad es el primer paso para emprender programas de mejoramiento genético, y al mismo tiempo permite recomendar a los productores variedades o híbridos resistentes o tolerantes a la enfermedad. El objetivo del presente estudio fue evaluar la resistencia genética de 32 híbridos comerciales a SCMV bajo inoculación artificial, a fin de determinar la existencia de genotipos resistentes a la enfermedad.
MATERIALES Y MÉTODOS
Inóculo del virus
A principios de 2015, se informó que los campos de maíz en el valle del río Portoviejo y sus alrededores estaban infectados por una enfermedad desconocida. Los síntomas se observaron por primera vez en líneas endogámicas plantadas para la producción de semillas durante la estación seca de 2014, y más tarde en los campos de los agricultores plantados con híbridos de varias marcas comerciales. Fuertes síntomas de mosaico estuvieron presentes en las hojas más jóvenes de las plantas infectadas. Muestras de plantas sintomáticas fueron llevadas al laboratorio y luego congeladas. Todas las muestras fueron positivas cuando se analizaron con tiras genéricas de diagnóstico de Potyvirus (Agdia). La presencia del Potyvirus SCMV en las muestras fue confirmada por DAS ELISA, según lo descrito por McDaniel y Gordon [13].
El virus se transfirió a la línea de maíz Oh28 por inoculación con frotación [11]. Se aisló ARN de plantas Oh28 infectadas y se amplificó con primers cebadores para SCMV (8400F: TGYGAYGCNGATGGYTC y 9200R: CAGCWGTGTGNCGNTCWGT) usando RT-PCR. Las bandas esperadas (1600 pb) se clonaron y secuenciaron. Las secuencias de amplicones se alinearon con otras secuencias en la base de datos GenBank (https://www.ncbi.nlm.nih.gov/genbank/) usando BLAST. Los resultados mostraron una alineación idéntica del 82 al 94% a un aislado de SCMV de Ohio (EEUU) para las regiones amplificadas. El virus se encuentra congelado en el Laboratorio de Protección Vegetal de la Estación Experimental Litoral Sur del INIAP.
Material vegetal e inoculación
El experimento se condujo bajo invernadero en la Estación Experimental Litoral Sur del INIAP utilizando un diseño completo al azar con 32 tratamientos, correspondientes a 32 híbridos comerciales y experimentales del INIAP, CIMMYT y empresas privadas Tabla 1. Cada híbrido fue sembrado en cinco macetas plásticas de 500 ml, que contenía suelo estéril, empleando cinco semillas en cada maceta, para un total de 25 plantas por tratamiento. Cada planta representó una observación.
Una semana después de la siembra se realizó la primera inoculación del virus en cuatro macetas (20 plantas) utilizando la técnica de frotación [12], repitiendo dos inoculaciones adicionales pasando un día, según lo descrito por Jones et al. [11]. Una maceta (5 plantas) quedó de control y no fue inoculada. El experimento se repitió por tres ocasiones en diferentes fechas de siembra.
Análisis estadístico
A los 14 días después de la primera inoculación se evaluó la incidencia de la enfermedad, en porcentaje, registrando el número de plantas que presentaron síntomas de infección por SCMV. Con el porcentaje de incidencia de cada réplica se realizó un análisis de varianza y se estimó el promedio y error estándar para cada tratamiento utilizando el paquete estadístico R [14].
RESULTADOS
A los siete días de la inoculación se observaron los primeros síntomas de la enfermedad, con plántulas ligeramente cloróticas a manera de mosaico en el foliolo más joven (datos no mostrados). A los 14 días de la primera inoculación se registró el número de plantas con síntomas de virosis y se estimó el porcentaje de incidencia. Las plantas testigos que no fueron inoculadas no presentaron síntomas de infección viral.
El análisis de varianza realizado para el porcentaje de incidencia de plantas afectadas con el virus del SCMV detectó diferencias estadísticas significativas al 1% (p<0.01) entre los híbridos de maíz inoculados. Los resultados indicaron que no existió resistencia completa a la enfermedad, presentando una distribución continua en el porcentaje de incidencia de la misma, con híbridos que presentaron resistencia parcial con 33.30% de incidencia, hasta híbridos completamente susceptibles con 96.67% de incidencia Tabla 1.
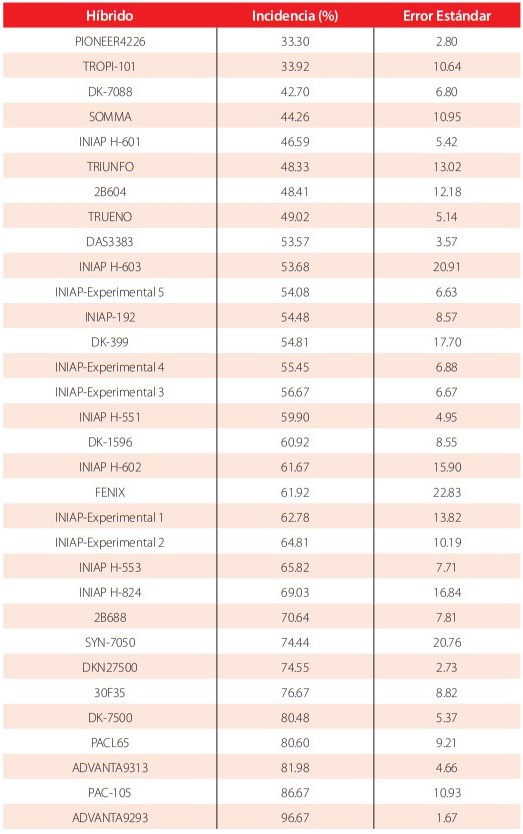
Respuesta de 32 híbridos comerciales y experimentales de maíz a la inoculación con Sugarcane mosaic virus (SCMV) evaluados bajo invernadero. Yahuachi, Ecuador 2016.
DISCUSIÓN
La evaluación de la resistencia genética de 32 híbridos tropicales de maíz a el virus SCMV determinó la existencia de resistencia parcial a la enfermedad (incidencia < a 40%) en solo dos de los híbridos evaluados: PIONEER 4226 y TROPI-101, que son híbridos de amplia adaptación en Latinoamérica. El 94% de los híbridos evaluados presentó susceptibilidad a SCMV “Tabla 1”, lo que demuestra la vulnerabilidad de la producción comercial de maíz frente a esta enfermedad.
La resistencia genética de genotipos tropicales de maíz amarillo duro al virus SCMV mediante inoculación artificial ha sido relativamente poco estudiada en la región. Rodriguez-Osorio et al. [15] evaluó en Venezuela la reacción de 21 híbridos de maíz a SCMV, encontrando pocos cultivares de empresas privadas que mostraron resistencia a la enfermedad; además se concluyó que los híbridos obtenidos en programas nacionales de mejoramiento de maíz mostraron una susceptibilidad importante, similar a lo encontrado en este estudio con los híbridos desarrollados por INIAP; sin embargo, CIMMYT reporta trabajos de selección para resistencia a SCMV en los procesos de mejoramiento genético [16, 17], habiendo identificado varias líneas resistentes. Interesantemente, el híbrido DK-7088 que fue reportado como resistente en Venezuela con 0 % de infección, en la presente investigación mostró una incidencia de 42.70%. Esta diferencia podría estar dada por la diferencia en virulencia de la cepa utilizada.
La resistencia genética del maíz a SCMV es uno de los casos más analizados a nivel mundial [9]. La resistencia genética del maíz a SCMV está dada en ciertas líneas de origen tropical y templado por QTLs mayores ubicados en los cromosomas tres, seis y diez con genes de efecto dominante [11]. Por ejemplo, el gen Mdm1, ubicado en el brazo corto del cromosoma seis, confiere resistencia parcial a SCMV, dependiendo de la virulencia del inóculo y la fuente de origen de la resistencia. Dos genes dominantes, Scm1 y Scm2, ubicados en el brazo corto del cromosoma seis y cerca del centrómero del cromosoma tres, respectivamente, confieren resistencia a SCMV en una línea de maíz de origen europeo [10].
Retrocruzas entre líneas élites de maíz y líneas donadoras de genes de resistencia a ciertos virus han sido utilizados para generar nuevas líneas con resistencia mediante selección asistida por marcadores moleculares [18], lo que abre la posibilidad de utilizar esta metodología para incorporar resistencia genética a la enfermedad.
La falta de híbridos con resistencia a la enfermedad y los avances en mejora genética obtenidos hasta el momento sugieren que es necesario implementar acciones en los programas de mejoramiento genético públicos y privados para desarrollar híbridos resistentes a SCMV para los trópicos latinoamericanos, ya que no se encontró germoplasma con altos niveles de resistencia. El desarrollar materiales con resistencia a SCMV será de gran beneficio para los productores latinoamericanos ya que evitarán las pérdidas que esta enfermedad está causando en ciertas regiones productoras de maíz.
Agradecimientos
A los organizadores de la XXII Reunión Latinoamericana del Maíz, en la cual se presentó un resumen del presente trabajo.
Referencias
Xie, L., Zhang, J., Wang, Q., Meng, C., Hong, J., Zhou, X. (2010). Characterization of Maize chlorotic mottle virus associated with Maize Lethal Necrosis disease in China. Journal of Phytopathology 159, 191-193.
Wangai, A.W., Redinbaugh, M.G., Kinyua, Z.M., Miano, D.W., Leley, P.K., Kasina, M., Mahuku, G., Scheets, K., Jeffers, D. (2012). First report of Maize chlorotic mottle virus and Maize Lethal Necrosis in Kenya. Plant Disease 96 (10): 1582.
Adams, I.P., Harju, V.A., Hodges, T., Hany, U., Skelton, A., Rai, S., Deka, M.K., Smith, J., Fox, A., Uzayisenga, B., Ngaboyisonga, C., Uwumukiza, B., Rutikanga, A., Rutherford, M., Ricthis, B., Phiri, N., Boonham, N. (2014). First report of maize lethal necrosis disease in Rwanda. New Disease Reports 29, 22.
Quito-Avila D.F., Alvarez, R.A., Mendoza, A.A. (2016) Occurrence of maize lethal necrosis in Ecuador: a disease without boundaries? European Journal of Plant Pathology 146 (3), 705-710.
Vásquez, J., Mora, E. (2007). Incidence and yield loss caused by Maize rayado fino virus in maize cultivars in Ecuador. Euphytica 153:339-342.
Ali, F. & Yan , J. (2012). Disease resistance in maize and the role of molecular breeding in defending against global threat. Journal ofIntegrative Plant Biology 54:134-151.
Zambrano, J. L., Francis, D. M., and Redinbaugh, M. G. (2013). Identification of resistance to Maize rayado fino virus in maize inbred lines. Plant. Dis. 97:1418-1423.
Lapierre, H., & Signoret P.A. (2004). Virus and virus disease ofpoacea (gramineae). Paris: INRA Editions.
Redinbaugh, M.G. & Zambrano, J.L. (2014). Control of Virus Diseases in Maize. In: Advances in Virus Research. Vol. 90, Pages 391-429.
Xu, M. L., Melchinger, A. E., and Lubberstedt, T. (2000). Origin of Scm1 and Scm2—two loci conferring resistance to Sugarcane mosaic virus (SCMV) in maize. Theor. Appl. Genet. 100:934-941.
Jones, M.W., Redinbaugh, M.G., Louie, R. (2007). The Mdm1 locus and maize resistance to Maize dwarf mosaic virus. Plant Dis. 91:185-190.
Zambrano, J. L., Jones, M. W., Brenner, E., Francis, D. M., Tomas, A., & Redinbaugh, M. G. (2014). Genetic analysis of resistance to six virus diseases in a multiple virus-resistant maize inbred line. Theor Appl Genet. 127(4):867-80.
McDaniel, L. L., and Gordon, D. T. (1989). Characterization of the oat-infecting strain of maize dwarf mosaic virus. Phytopathology 79:113-120.
R Core Team. (2013). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. http://www.R-project.org/
Rodríguez-Osorio, R., Garrido, M., Figueroa, R., Borges, O., Brito, M. (2015). Reacción de cultivares comerciales de maíz (Zea mays L.) a la inoculación mecánica con tres potyvirus. Bioagro Vol.27 (2).
Salazar, S., De León C. (2001). Selección de líneas de maíz (Zea mays L.) con resistencia al virus del mosaico de la caña de azúcar (SCMV). Fitopatología Colombiana, 25(1): 15-17
Cruz-Perez, N. (2016). Resistencia al virus moteado clorótico del maíz y al virus del mosaico de la caña de azúcar. Tesis: Universidad Autónoma Agraria Antonio Narro. México. Disponible en: http://repositorio.uaaan.mx:8080/xmlui/handle/123456789/8002
Brewbaker, J.L. & Josue, A.D. (2007). Registration of 27 maize parental inbred lines resistant to maize mosaic virus. Crop Sci. 47, 459-461.
Información adicional
CONTRIBUCIONES
DE LOS AUTORES: José Luis Zambrano y Lenín
Paz concibieron la investigación, desarrollaron la metodología y realizaron el
trabajo de campo. J. Zambrano realizó los análisis estadísticos y escribió el
manuscrito. Margaret Redinbaugh realizó el análisis
molecular del virus y revisión de los resultados.